三迭紀(jì)3D打印胃滯留藥品獲得FDA批準(zhǔn),可用于治療肺動(dòng)脈和血栓疾病
時(shí)間:2024-02-02 10:19 來(lái)源:南極熊 作者:admin 閱讀:次
2024年2月1日,美國(guó)食品和藥物管理局 (FDA) 已批準(zhǔn)3D
打印制藥公司三迭紀(jì)(Triastek)繼續(xù)執(zhí)行其 3D 打印 T22 的新藥研究(IND),使其成為第一個(gè)獲得此指定的 3D
打印胃滯留產(chǎn)品。目前,Triastek正在準(zhǔn)備啟動(dòng)T22 的臨床研究,以加快產(chǎn)品開(kāi)發(fā)。

Triastek 的 T22 產(chǎn)品是一種 505(b)(2) 產(chǎn)品,用于治療肺動(dòng)脈高壓 (PAH)
和慢性血栓栓塞性肺動(dòng)脈高壓 (CTEPH)。T22 采用Triastek 的創(chuàng)新熔體擠出沉積 (MED) 加上微注射成型 (MIM)
工藝生產(chǎn),并利用其胃滯留 3D 微結(jié)構(gòu) (3DμS-GR)
交付技術(shù)平臺(tái)。與原研產(chǎn)品目前每日3次給藥相比,T22將給藥頻率降低至每日1次,簡(jiǎn)化了給藥方案并提高了用藥依從性。
Triastek 的專有技術(shù)熔體擠出沉積 (MED) 3D 打印工藝與數(shù)字配方開(kāi)發(fā)方法相結(jié)合,可實(shí)現(xiàn)復(fù)雜的藥物輸送和程序化釋放。Triastek還積極開(kāi)發(fā)新技術(shù)工藝,包括半固態(tài)擠出、微注射成型和微滴噴射。這些技術(shù)與 MED 的結(jié)合為藥物輸送和開(kāi)發(fā)需求提供了廣泛的解決方案,例如口服肽、胃滯留和高效產(chǎn)品。

Triastek
創(chuàng)始人兼首席執(zhí)行官程森平博士表示:“基于我們專有的3D微結(jié)構(gòu)胃滯留給藥技術(shù)平臺(tái),我們開(kāi)發(fā)的兩款產(chǎn)品T20G和T22今年已獲得中國(guó)和美國(guó)監(jiān)管機(jī)構(gòu)的IND許可,標(biāo)志著Triastek在這一領(lǐng)域邁出了成功的第一步。
創(chuàng)新的運(yùn)輸技術(shù)平臺(tái)正在通過(guò)監(jiān)管審查程序。2021年,Triastek和SperogenixTherapeutics就T22在東亞的開(kāi)發(fā)和商業(yè)化達(dá)成了共同開(kāi)發(fā)協(xié)議,以展示3D微結(jié)構(gòu)胃滯留輸送技術(shù)的臨床應(yīng)用價(jià)值。基于T22的進(jìn)展,多個(gè)國(guó)家和地區(qū)的公司表示有興趣利用該藥物輸送技術(shù)平臺(tái)進(jìn)行產(chǎn)品開(kāi)發(fā)的潛在合作。”
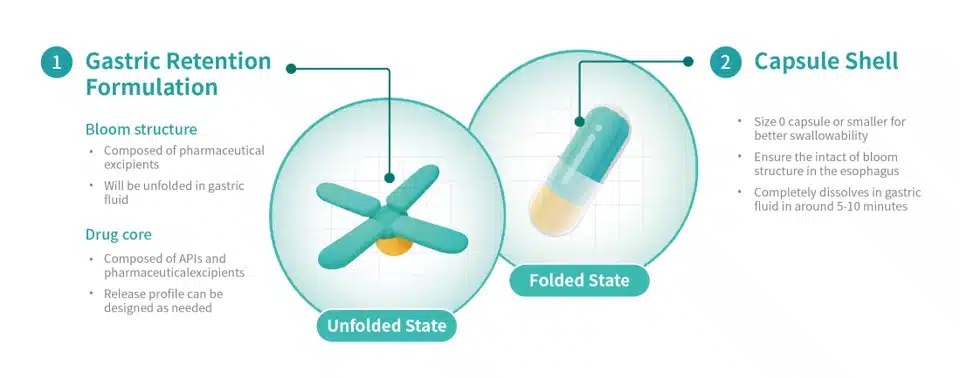
Triastek已完成T22胃滯留制劑的開(kāi)發(fā),在體外擴(kuò)張時(shí)間、機(jī)械強(qiáng)度和溶出行為方面取得了積極成果,并完成了T22胃滯留原型在比格犬中的PK研究。據(jù)報(bào)道,藥代動(dòng)力學(xué)研究表明,每日一次給予相同每日總劑量的
T22 胃滯留試驗(yàn)原型可提供與原研產(chǎn)品 TID 劑量相當(dāng)?shù)?PK 參數(shù)。
隨著T22獲得FDA批準(zhǔn),Triastek共有四種3D打印藥物產(chǎn)品(T19、T20、T21和T22)進(jìn)入臨床開(kāi)發(fā)階段,在全球3D打印藥物領(lǐng)域排名第一開(kāi)發(fā)產(chǎn)品數(shù)量。隨著T系列管線的快速推進(jìn)以及3D打印藥物技術(shù)臨床價(jià)值的不斷驗(yàn)證,Triastek不斷為全球市場(chǎng)開(kāi)發(fā)新技術(shù)和新產(chǎn)品。目前,公司的兩大主要業(yè)務(wù)模式包括“產(chǎn)品授權(quán)合作”和“技術(shù)平臺(tái)合作”。
Triastek 開(kāi)發(fā)的用于胃滯留輸送技術(shù)的 3D 微結(jié)構(gòu)及其獨(dú)特的 Bloom 結(jié)構(gòu)設(shè)計(jì)已提交 PCT
專利申請(qǐng)。口服給藥后,胃滯留原型膨脹至大于幽門(mén)直徑,從而延長(zhǎng)胃滯留時(shí)間。在胃滯留期間,原型根據(jù)預(yù)定的程序藥物釋放行為釋放
API。在簡(jiǎn)化給藥方案、減輕用藥負(fù)擔(dān)、提高患者長(zhǎng)期用藥依從性的同時(shí),還可以提高藥物吸收和口服生物利用度,從而改善患者的治療效果。
(責(zé)任編輯:admin)
上一篇:通快與Exploration合作為Nyx航天器開(kāi)發(fā)3D打印核心部件
下一篇:西工大張衛(wèi)紅院士:結(jié)構(gòu)優(yōu)化和增材制造技術(shù)在高速飛行器上的應(yīng)用和挑戰(zhàn)
下一篇:西工大張衛(wèi)紅院士:結(jié)構(gòu)優(yōu)化和增材制造技術(shù)在高速飛行器上的應(yīng)用和挑戰(zhàn)
最新內(nèi)容
- ·Axial3D 與 GE HealthCare 合作,實(shí)現(xiàn)
- ·3D打印魚(yú)肉即將在新加坡及其他地區(qū)商業(yè)
- ·美女在TikTok上展示自己購(gòu)買(mǎi)的3D打印四
- ·Signify通過(guò)3D打印技術(shù)打印數(shù)千盞照明
- ·組織損傷原位定制化修復(fù)的積木式3D打印
- · 3D打印使宜家家具個(gè)性化
- · 豐田將3D打印融入其全新SUV概念車(chē)中
- ·3D打印水凝膠隱形眼鏡,可在眼部持續(xù)釋
- ·Renishaw3D打印技術(shù)提升了蒙特利爾Form
- ·特溫特大學(xué)研發(fā)創(chuàng)新3D生物墨水技術(shù),精
熱點(diǎn)內(nèi)容
- ·3D打印神作:用3D打印筆“畫(huà)”出的超美
- ·有3D打印機(jī)不用裝修了,看看3d打印的一
- ·自己動(dòng)手做一臺(tái)只需20美元的3D打印微型
- ·街機(jī)迷注意了:用樹(shù)莓派+3D打印機(jī)可制
- ·盤(pán)點(diǎn)3D打印在修復(fù)文物古跡中的經(jīng)典案例
- ·圖解:3D打印假牙生產(chǎn)流程
- ·SOLS公司發(fā)布可定制的3D打印矯形鞋墊
- ·盈創(chuàng)3D打印建筑經(jīng)典案例分享
- ·10件獨(dú)特的3D打印花盆,總有一件是你喜
- ·3D打印在室內(nèi)裝修的應(yīng)用:點(diǎn)燃你對(duì)空間


 Axial3D 與 GE HealthCare
Axial3D 與 GE HealthCare 3D打印魚(yú)肉即將在新加坡及
3D打印魚(yú)肉即將在新加坡及 美女在TikTok上展示自己購(gòu)
美女在TikTok上展示自己購(gòu) Signify通過(guò)3D打印技術(shù)打
Signify通過(guò)3D打印技術(shù)打 組織損傷原位定制化修復(fù)的
組織損傷原位定制化修復(fù)的 3D打印使宜家家具個(gè)性化
3D打印使宜家家具個(gè)性化 3D打印實(shí)現(xiàn)外固定
3D打印實(shí)現(xiàn)外固定 哥倫比亞大學(xué)采用
哥倫比亞大學(xué)采用 失去1/3掌面,浙大
失去1/3掌面,浙大 3D打印軟皮墊增強(qiáng)
3D打印軟皮墊增強(qiáng) 3D打印替換患病脊
3D打印替換患病脊 功能材料新“大門(mén)
功能材料新“大門(mén)

