修飾脂質納米顆粒:實現軟骨長效留存,助力骨關節炎與軟骨缺損修復
骨關節炎(OA)會致使關節軟骨逐漸退化,目前針對OA的早晚期均缺乏有效的治療手段。軟骨再生需要多種藥物在損傷部位發揮作用并長時間留存,以招募內源性細胞,促進軟骨形成。然而,關節腔內藥物清除速度快,且軟骨細胞外基質無血管、結構致密,這些因素成為藥物輸送的主要障礙,導致許多藥物半衰期短,難以發揮療效。同時,現有的納米顆粒藥物遞送系統存在靶向性差、難以穿透軟骨、載藥量低等問題,在治療早期骨關節炎和全層軟骨缺損方面效果不佳。
北京航空航天大學生物與醫學工程學院、生物力學與力生物學教育部重點實驗室樊瑜波教授團隊設計了一種軟骨結合肽修飾的脂質納米顆粒(CBP - ICMVs)作為藥物載體,通過系統篩選多種靶向膠原II或軟骨細胞的肽,確定了一種源自核心蛋白聚糖的肽修飾的納米顆粒,其具有精準靶向和在軟骨中長時間留存的能力。該團隊還通過多層囊泡相鄰脂質雙層間的交聯,提高了納米顆粒的穩定性、載藥量和雙藥持續釋放性能。在大鼠OA手術模型和兔全層軟骨缺損模型中,這種納米顆粒能有效促進軟骨再生。相關工作以“Bioinspired Lipid Nanoparticles with Prolonged Cartilage Retention Boost Regeneration in Early Osteoarthritis and Large Cartilage Defects”為題發表在《ACS Nano》上。 樊瑜波教授、王麗珍教授和侯森助理教授為該論文的共同通訊作者,第一作者為北航生物與醫學工程學院的周瑾副教授、碩士研究生周悅和北醫三院的王關卉兒博士。

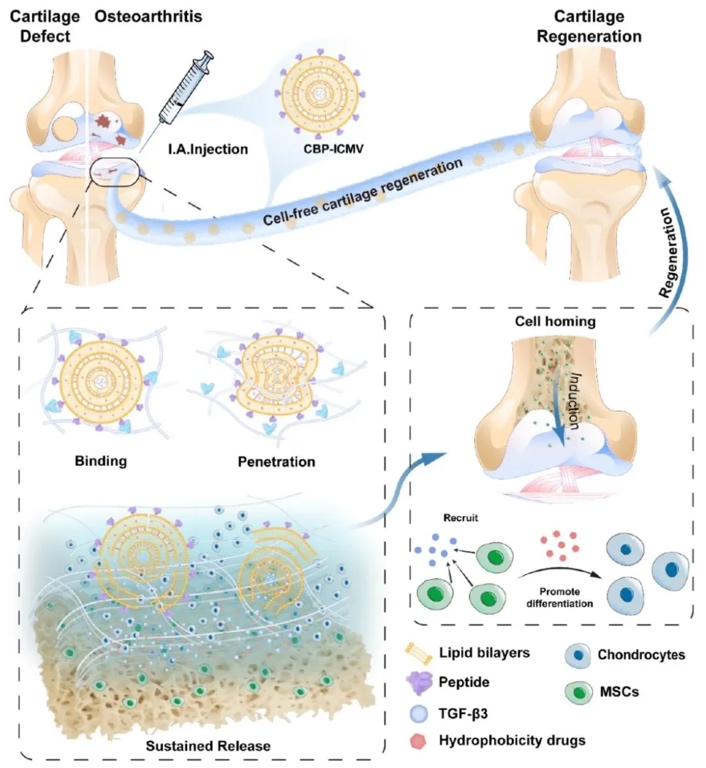
研究內容
1. CBP-ICMVs的合成及物理表征:通過化學合成、透射電鏡(TEM)、動態光散射(DLS)、ζ電位測定等方法,研究CBP-ICMVs的合成過程、結構、粒徑、表面電荷以及不同肽修飾對其結合能力的影響。結果表明,成功合成CBP-ICMVs,其粒徑隨合成步驟逐漸增大,ζ電位變化證實了肽的成功共軛;不同肽修飾的ICMVs對膠原蛋白的結合能力不同,LRELHLNNN修飾的ICMVs結合能力最強,且20%的修飾密度時效果最佳。

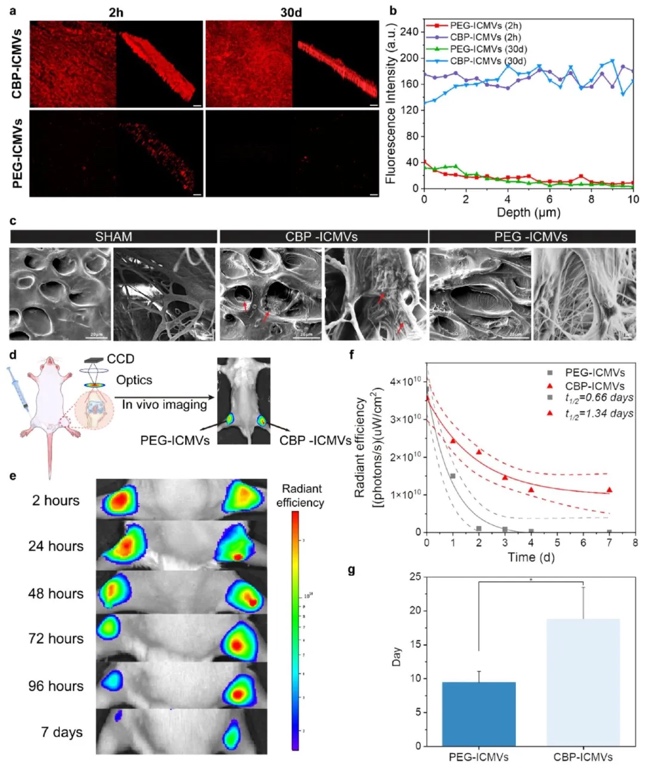
2. CBP-ICMVs在體外和體內延長軟骨駐留時間并穿透軟骨細胞外基質:運用共聚焦顯微鏡觀察、掃描電鏡(SEM)、體內成像系統(IVIS)等技術,以兔軟骨切片和小鼠膝關節為研究對象,探究CBP-ICMVs的穿透和滯留能力。結果顯示,CBP-ICMVs在體外能快速穿透并長時間滯留在軟骨細胞外基質中,其熒光強度在2小時和30天時均顯著高于對照的PEG-ICMVs;在體內,CBP-ICMVs在小鼠膝關節中的滯留時間明顯長于PEG-ICMVs,關節內半衰期從0.66天延長至1.34天,提高了藥物遞送效率。
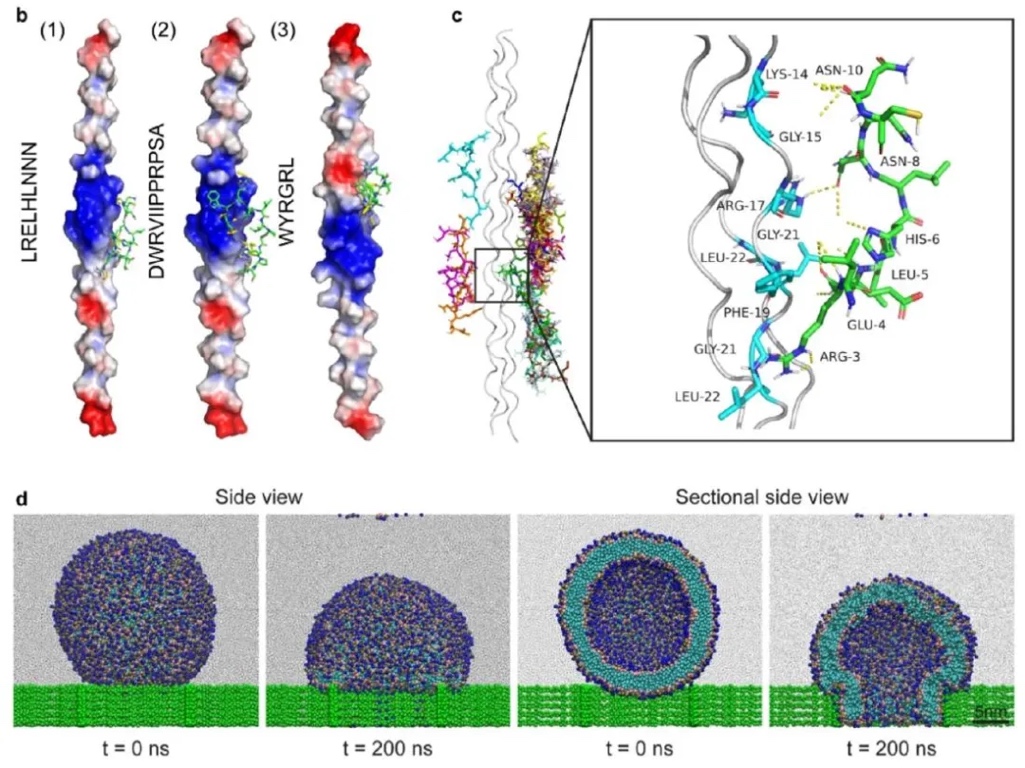
3. 人源II型膠原蛋白與三種選定肽的結合模式評估:采用分子對接和粗粒化分子動力學(MD)模擬的方法,研究三種肽(LRELHLNNN、DWRVIIPPRPSA、WYRGRL)與II型膠原蛋白的結合親和力和結合模式,以及脂質體穿透軟骨細胞外基質的能力。結果表明,LRELHLNNN與II型膠原蛋白的結合親和力最高,為-7.7kcal/mol;MD模擬證實了脂質體可通過結構變形穿透比自身直徑小的網格結構,驗證了其穿透軟骨細胞外基質的能力。
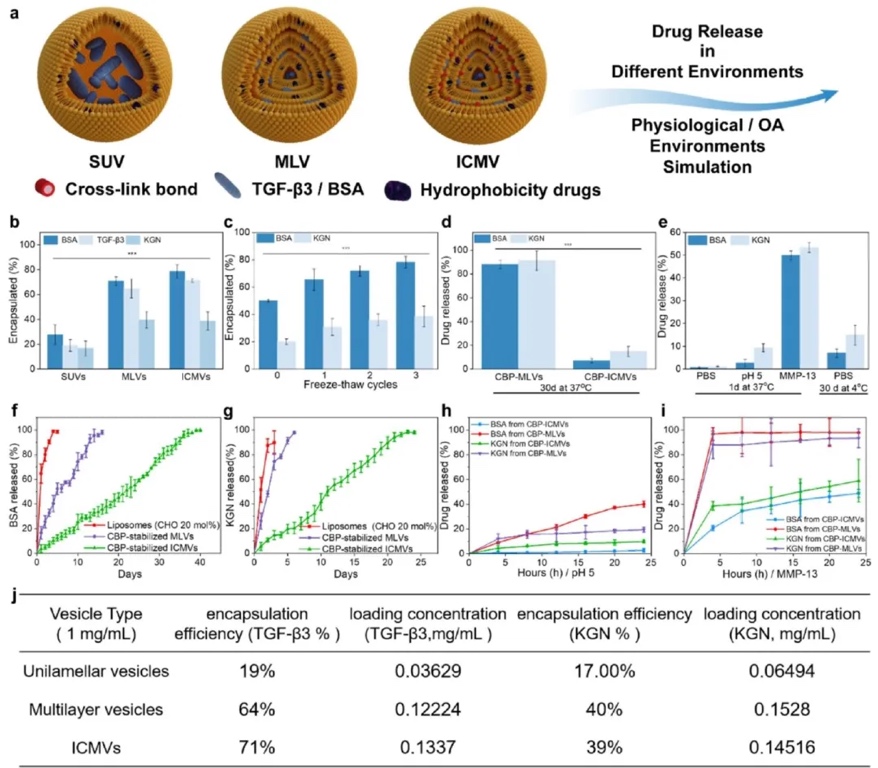
4. ICMVs負載藥物的生物活性保留:通過測定不同階段ICMVs對模型蛋白(BSA、TGF-β3)和疏水性藥物(KGN)的包封率、藥物釋放動力學以及在不同環境下的穩定性,研究ICMVs對負載藥物生物活性的保留能力。結果表明,ICMVs的載藥量隨合成步驟增加,對TGF-β3和KGN的包封率分別約為70%和39%;在37℃的PBS緩沖液中,ICMVs能顯著延長藥物釋放時間,在模擬OA微環境中也表現出良好的穩定性。
5. CBP-ICMVs負載KGN和TGF-β3促進MSCs體外向透明軟骨分化:利用細胞培養、細胞化學染色、免疫細胞化學染色、RT-qPCR等技術,以人脂肪來源的間充質干細胞(hADSCs)為研究對象,探究CBP-ICMVs負載KGN和TGF-β3對MSCs向透明軟骨分化的影響。結果顯示,CBP-ICMVs負載KGN和TGF-β3的實驗組(KT組),在細胞化學染色中產生更多的糖胺聚糖分泌,免疫細胞化學染色中II型膠原蛋白表達最高,RT-qPCR分析表明該組增強了軟骨生成相關基因的表達,促進了MSCs向透明軟骨分化。
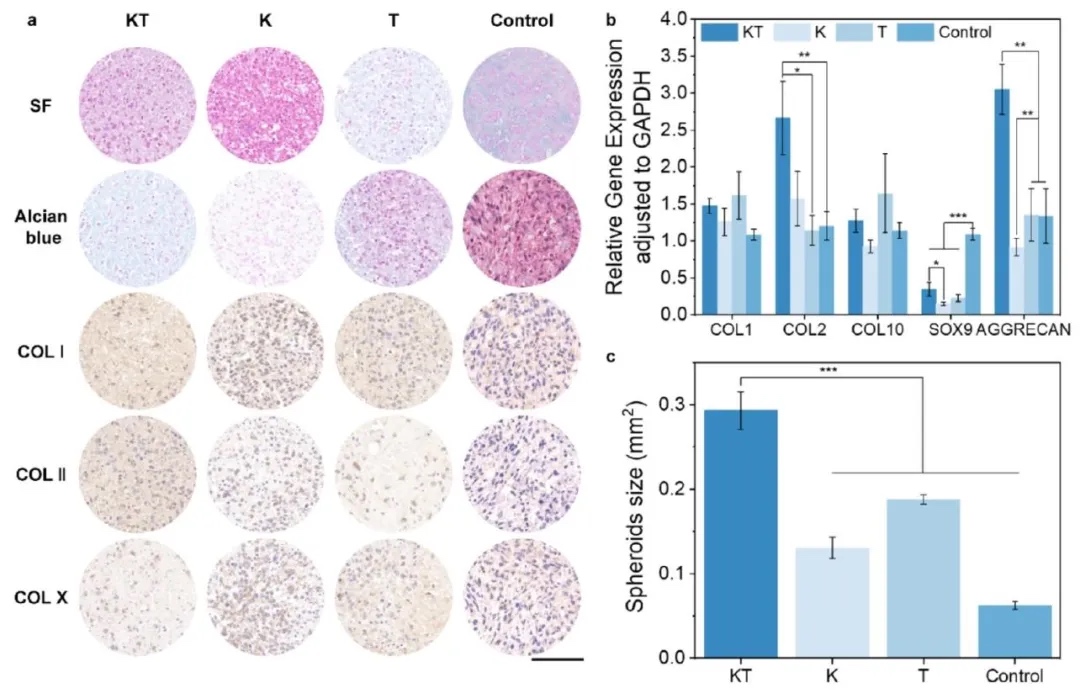
6. CBP-ICMVs負載KGN和TGF-β3減輕大鼠ACLT+DMM模型的軟骨退化及治療OA的能力:建立大鼠ACLT+DMM手術模型,通過組織學染色(HE、番紅O、甲苯胺藍)、免疫組織化學染色(Col I、Col II、Aggrecan)、OARSI評分等方法,研究CBP-ICMVs對早期OA的治療效果。結果表明,與PEG-ICMVs組相比,CBP-ICMVs組的軟骨損傷明顯改善,軟骨表面更光滑,Col II和Aggrecan的表達增加,OARSI評分更低,有效減輕了軟骨退化,促進了OA的治療。

7. CBP-ICMVs負載KGN和TGF-β3修復兔模型軟骨缺損:構建兔全層軟骨缺損模型,運用組織學染色(HE、番紅O、甲苯胺藍)、免疫組織化學染色(Col II)、OARSI評分等方法,評估CBP-ICMVs對兔軟骨缺損的修復能力。結果顯示,CBP-ICMVs組的軟骨缺損填充效果顯著,修復的軟骨組織與天然組織相似,番紅O染色顯示有更多的II型膠原蛋白形成,OARSI評分明顯改善,表明其能有效修復全層軟骨缺損。

研究結論
本研究表明,藥物遞送系統實現軟骨修復再生的關鍵在于調控藥物的時空分布和聯合效應。體內評估顯示,軟骨缺損被類似透明軟骨修復,組織學評估中軟骨界面整合評分顯著提高。釋放的KGN和TGF-β3顯著增強了軟骨細胞的活力和增殖能力,增加了缺損界面修復組織的質量和數量,這意味著兩種藥物恰當的時空分布和聯合效應有效調節了間充質干細胞的招募與分化。該結果說明,提高藥物遞送的準確性和有效性,有望為軟骨缺損修復帶來臨床突破。未來,還可從以下方面進一步優化:一是增加功能恢復評估,如定量步態分析、負重對稱性和疼痛相關生物標志物檢測;二是探索其他生物活性因子與TGF-β3/KGN聯合使用,協同促進透明軟骨形成和軟骨下骨重塑;三是過渡到大型動物模型,更準確地模擬人體關節的生物力學、缺氧微環境和免疫反應,嚴格評估軟骨的長期完整性、機械彈性和宿主相容性。
文章來源:
https://doi.org/10.1021/acsnano.4c13828
(責任編輯:admin)


 3D打印復合材料性能瓶頸:
3D打印復合材料性能瓶頸: 3D打印膠體氣凝膠—材料世
3D打印膠體氣凝膠—材料世 斯坦福大學團隊:高延展物
斯坦福大學團隊:高延展物 用于3D打印的阻燃和阻燃塑
用于3D打印的阻燃和阻燃塑 彩色3D打印線材介紹
彩色3D打印線材介紹 nano3Dprint發布
nano3Dprint發布 3D Systems推出Ne
3D Systems推出Ne 3D打印超高強納米
3D打印超高強納米 UCLA鄭小雨教授:
UCLA鄭小雨教授: 意大利研究者研發
意大利研究者研發 Nature發表ZrO2-S
Nature發表ZrO2-S

