雙相載細胞介質賦能3D打印:構建體外復雜血管化肝臟組織新突破
肝臟作為人體最大的消化腺,承擔著蛋白質合成、代謝等重要生理功能。然而,藥物或疾病引發的肝損傷會影響其再生能力。構建能精準模擬健康人體肝臟生理功能的體外三維模型,對提升實驗準確性、推動藥物研發和臨床應用意義重大。肝臟血管系統復雜,體外構建復雜血管網絡,維持充足養分供應,對細胞生長、模擬肝臟異質結構和細胞微環境至關重要。 3D生物打印技術雖在構建復雜肝臟組織方面有進展,但現有方法仍存在諸多局限。例如,同軸擠出打印受噴嘴結構限制,難以形成穩定的分叉微血管;傳統犧牲打印的層層堆疊法,因低模量水凝膠黏度低、難以自支撐,不易構建復雜三維血管結構,且細胞載藥生物墨水的流變學特性變化會影響打印可行性。同時,現有方法在材料選擇上受限,細胞載微球制備復雜、通量低,不利于大規模組織構建。 為解決這些問題,浙江大學馬梁教授團隊開發出一種可交聯的雙相嵌入介質,通過混合低黏度生物材料和明膠微凝膠,克服了傳統方法的局限。相關工作以“Construction of complex three - dimensional vascularized liver tissue model in vitro based on a biphasic cell - laden embedding medium”為題發表在《International Journal of Extreme Manufacturing》上。

1.構建復雜三維血管化肝組織體外模型的方法
通過開發一種可交聯的雙相細胞負載嵌入介質,研究了在體外構建復雜三維血管化肝組織模型的可行性,結果表明該方法能夠實現精確的三維血管結構構建,并促進肝細胞與內皮細胞的緊密粘附。
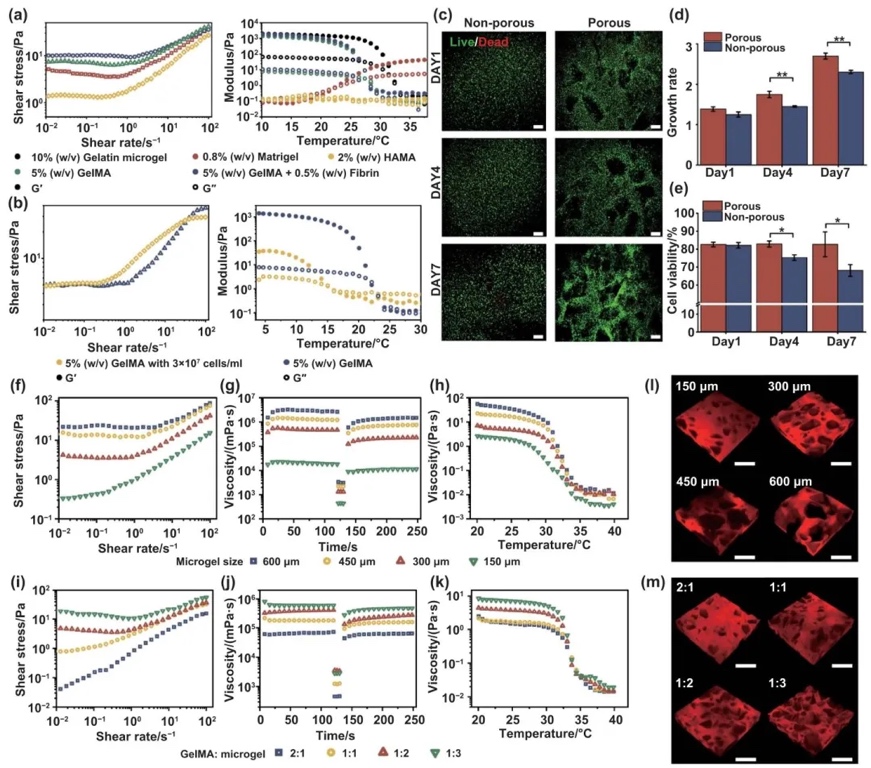
2.雙相細胞負載介質的流變學特性及生物相容性
通過流變學測試和細胞實驗,研究了雙相細胞負載介質的流變學特性及其對細胞活性的影響,結果表明該介質具有良好的流變學性能和生物相容性,能夠支持細胞的增殖和存活。
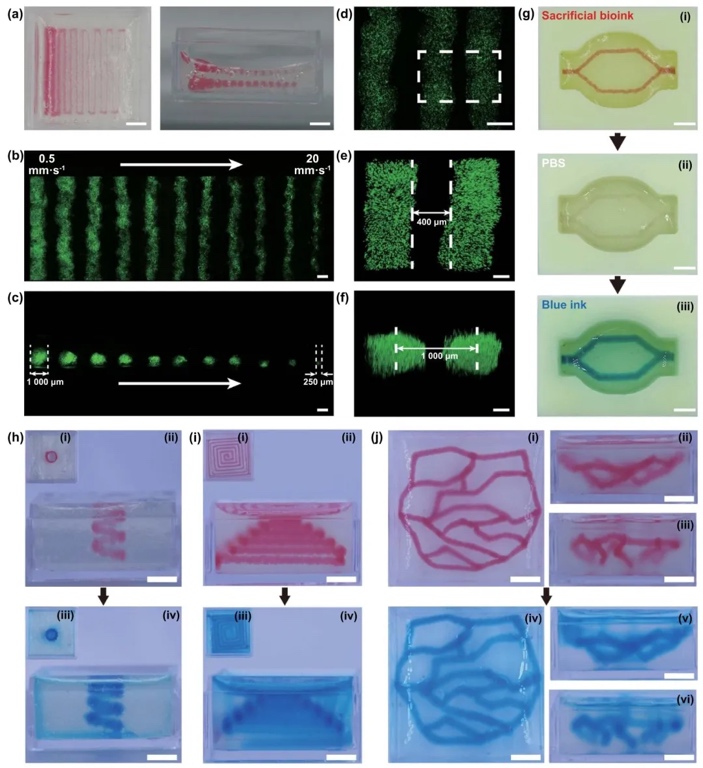
3.犧牲打印復雜結構
通過嵌入式打印技術,研究了在雙相介質中構建復雜三維血管結構的能力,結果表明通過調整打印速度可以精確控制血管直徑,并成功構建了多種復雜的血管網絡結構。
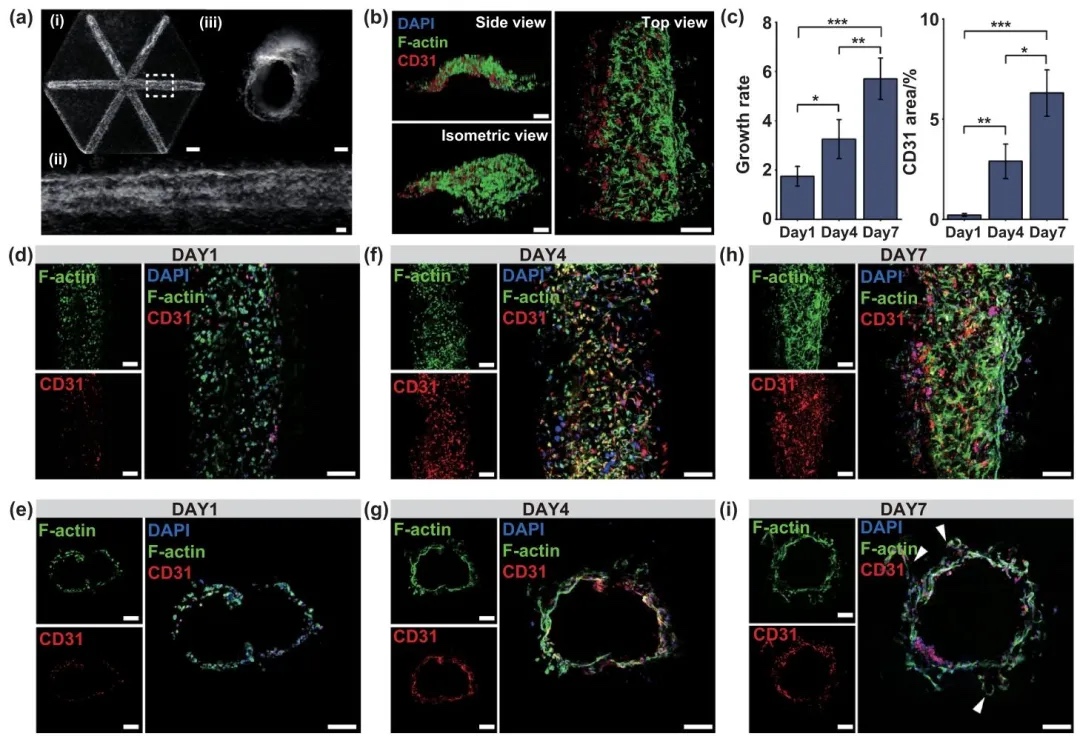
4.血管化肝組織構建
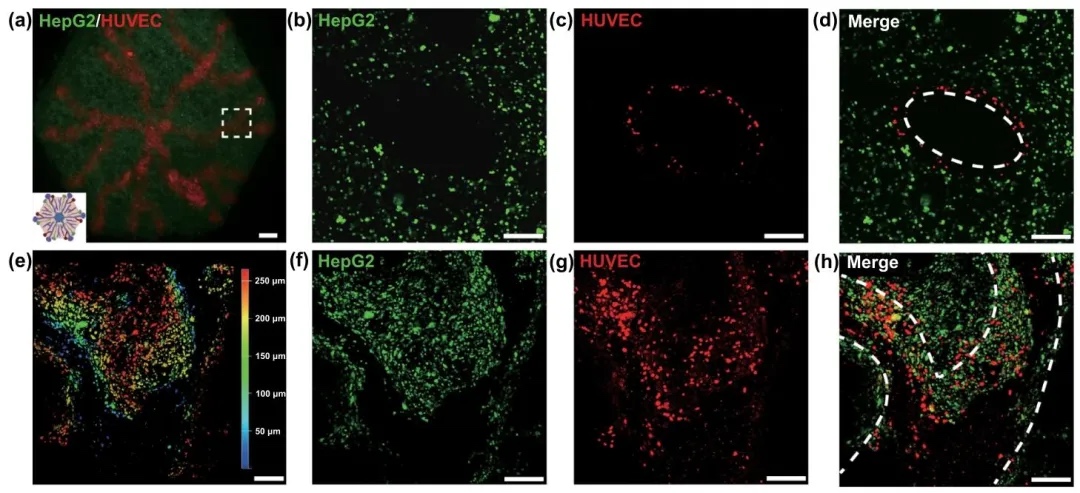
通過將內皮細胞負載的犧牲墨水嵌入雙相介質,研究了在體外構建血管化肝組織的過程,結果表明內皮細胞能夠在打印結構中形成連續的血管網絡,并與肝細胞緊密粘附。
5.血管化肝組織的功能特性
通過對血管化和非血管化肝組織的功能進行對比分析,研究了血管化對肝組織功能的影響,結果表明血管化肝組織在蛋白質合成、代謝功能和肝損傷標志物表達方面均優于非血管化模型。

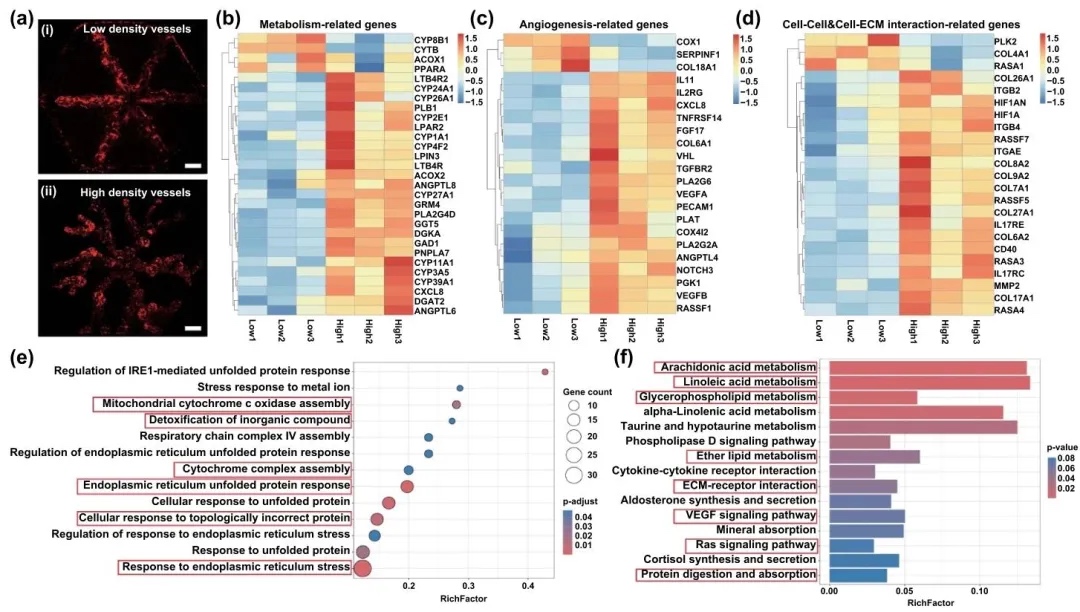
6.不同血管密度對肝組織功能的轉錄組測序分析
通過對不同血管密度的肝組織進行轉錄組測序,研究了血管密度對肝組織功能的影響,結果表明高血管密度的肝組織在代謝和血管生成相關基因表達方面顯著上調。
研究結論
本研究利用與明膠微凝膠混合的水凝膠制備了可負載細胞的支撐浴。該方法適用多種材料,明膠微凝膠可調節支撐浴的流變特性和組織孔隙率,進而創建可調節的肝臟微環境。通過嵌入式打印技術,連續打印犧牲生物墨水形成三維結構,調整打印速度能控制血管直徑,構建出具有可灌注血管網絡的肝臟組織模型。同時,原位內皮化方法構建了復雜血管結構,促進了肝細胞與內皮細胞的緊密相互作用。體外肝臟功能測試表明,相比簡單混合細胞形成的三維組織模型,用該方法構建的血管化組織在蛋白質和基因表達水平上更高。最后評估了不同血管密度對肝臟組織功能的影響,轉錄組測序顯示高血管密度的肝臟組織在脂質代謝和血管生成相關途徑的基因表達上調。盡管該方法存在路徑規劃復雜和墨水沉積精度有限等挑戰,但在構建高細胞密度組織方面潛力巨大,為后續肝臟組織研究提供了有前景的方法。
挑戰與展望
本研究在構建體外血管化肝臟組織模型方面取得重要進展,但仍面臨挑戰。構建三維血管結構時,路徑規劃復雜,當前技術難以實現墨水沉積的亞百微米精度,限制了模型的精細化程度。此外,在大規模應用方面,實驗操作的復雜性和成本也是需要克服的問題。
展望未來,研究可聚焦于提高細胞密度,以構建功能更完善的肝臟組織。優化打印參數和設備,突破墨水沉積精度的限制,提升血管結構的構建質量。同時,拓展材料選擇范圍,深入探究不同材料組合對肝臟組織微環境的影響,增強模型的生理相關性。進一步結合其他前沿技術,如微流控技術、人工智能輔助設計等,有望實現更高效、精準的肝臟組織工程構建,為肝臟疾病研究、藥物研發等提供更可靠的體外模型。
文章來源:
https://iopscience.iop.org/article/10.1088/2631-7990/ada836
(責任編輯:admin)


 Fabric8Labs推出AI芯片定
Fabric8Labs推出AI芯片定 Titomic又一合作,將與nuF
Titomic又一合作,將與nuF 荷蘭公司將開設3D打印船舶
荷蘭公司將開設3D打印船舶 Chicago Additive推出AMOS
Chicago Additive推出AMOS 590MHz帶寬+超90%輻射效率
590MHz帶寬+超90%輻射效率 威斯康星大學麥迪遜分校工
威斯康星大學麥迪遜分校工 突破性生物3D打印
突破性生物3D打印 迪拜LEAP 71公司
迪拜LEAP 71公司 3D生物打印構建內
3D生物打印構建內 《Small Science
《Small Science 南洋理工-劍橋大
南洋理工-劍橋大 清華大學:抗拉強
清華大學:抗拉強

