3D打印鈦小梁支架緩釋低氧誘導外泌體介導雙重仿生骨再生
當前臨床上面臨的主要問題是,嚴重創傷、腫瘤切除或感染等導致的大段骨缺損修復困難,傳統治療方式如自體骨移植存在供體不足和并發癥,異體骨移植有免疫風險,合成材料支架則缺乏骨誘導性和血管化能力,鈦合金(Ti-6Al-4V)植入物雖力學性能優異,但存在彈性模量過高(≈110 GPa)導致應力屏蔽、表面生物惰性難以促進血管生成等局限。
來自南方醫科大學黃文華教授、吳耀彬教授以及胡孔和主任醫師團隊、暨南大學利時雨副教授團隊合作開展了相關研究,他們開發了一種雙重仿生策略,設計了3D打印仿生小梁多孔鈦合金支架(BTPS),并通過微流控技術制備了負載低氧誘導人臍靜脈內皮細胞來源外泌體(HExo)的PEGDA/GelMA水凝膠微球(PGHExo),利用聚多巴胺(pDA)修飾將微球錨定在支架表面(BTPS&pDA@PGHExo)。該支架通過Voronoi算法模擬天然骨小梁的幾何結構與力學性能(彈性模量≈3.2 GPa,滲透率11.52×10⁻⁸ mm²),結合HExo的持續釋放(體外釋放≥30天),協同促進成骨分化和血管生成。
相關工作以“3D-Printed Titanium Trabecular Scaffolds with Sustained Release of Hypoxia-Induced Exosomes for Dual-Mimetic Bone Regeneration”為題發表在《Advanced Science》上。
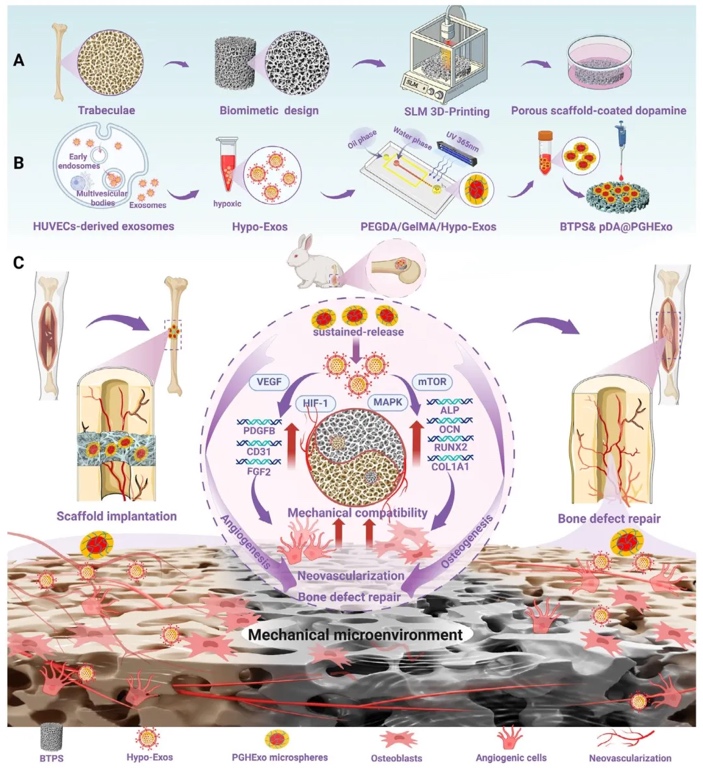
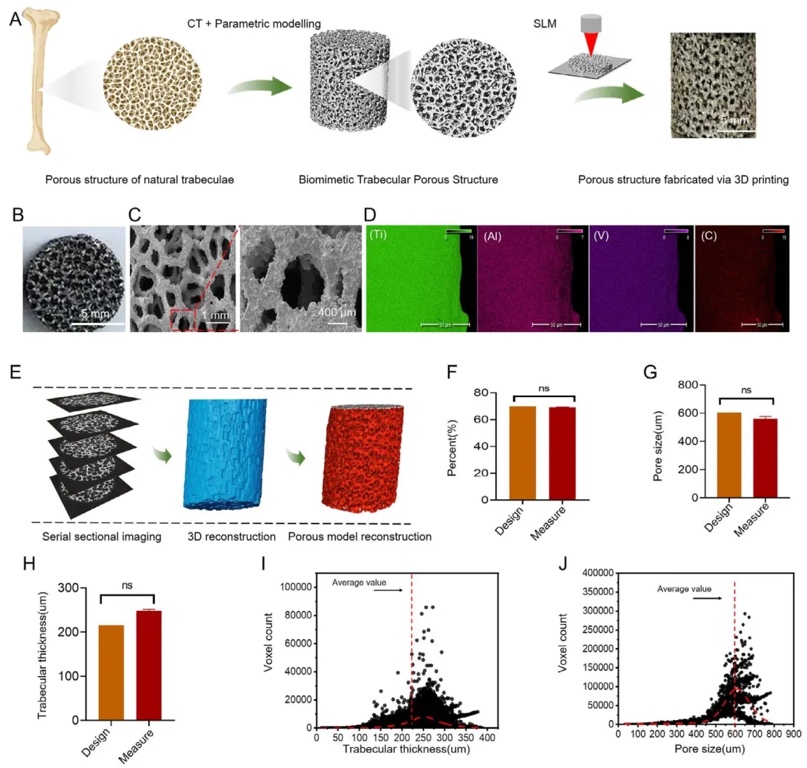
1. 仿生小梁鈦支架的設計與制備,通過Voronoi算法結合股骨松質骨CT數據建模,并利用選擇性激光熔融(SLM)3D打印技術,制備了孔隙率70%、平均孔徑560 μm的BTPS鈦支架。通過掃描電子顯微鏡(SEM)、能譜分析(EDS)及工業CT驗證,結果顯示支架表面光滑、元素分布均勻(Ti/Al/V比例符合Ti-6Al-4V標準),內部孔隙連通性良好,力學測試表明其彈性模量為3.2 GPa,接近天然松質骨。
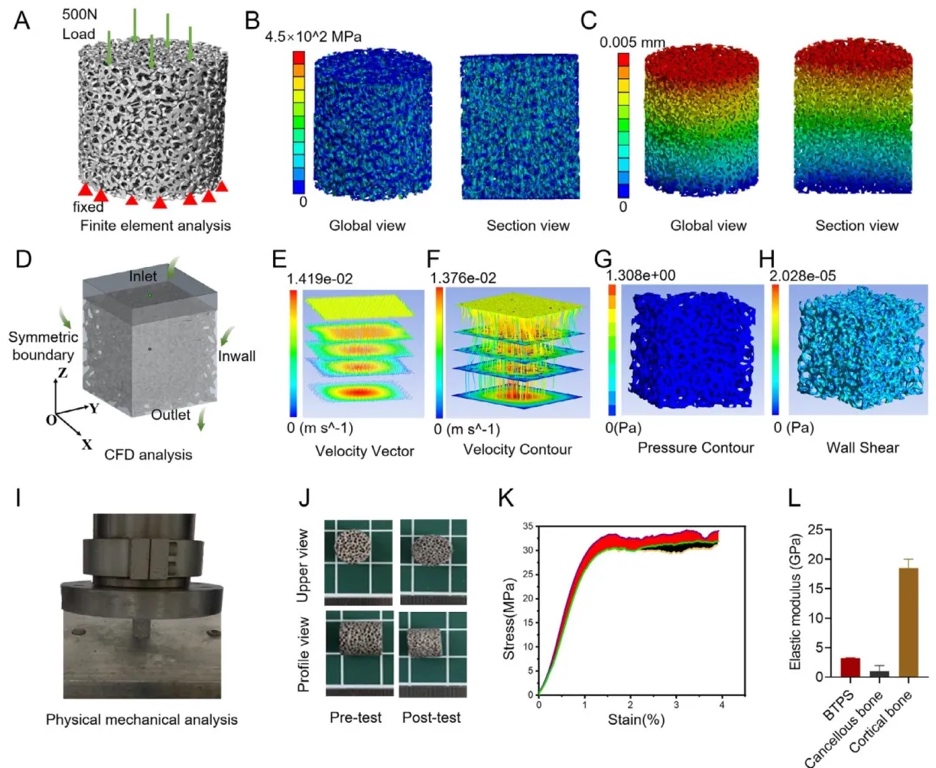
2. 支架力學性能與流體動力學分析,采用有限元分析(FEA)模擬支架在500 N壓縮載荷下的應力分布,結果顯示最大應力454.26 MPa,無應力集中;計算流體動力學(CFD)顯示支架內流體流速均勻(無湍流),滲透率為11.52×10⁻⁸ mm²,證實其力學穩定性和物質傳輸效率。壓縮測試進一步驗證支架屈服載荷達3085.25 N,符合承重需求。
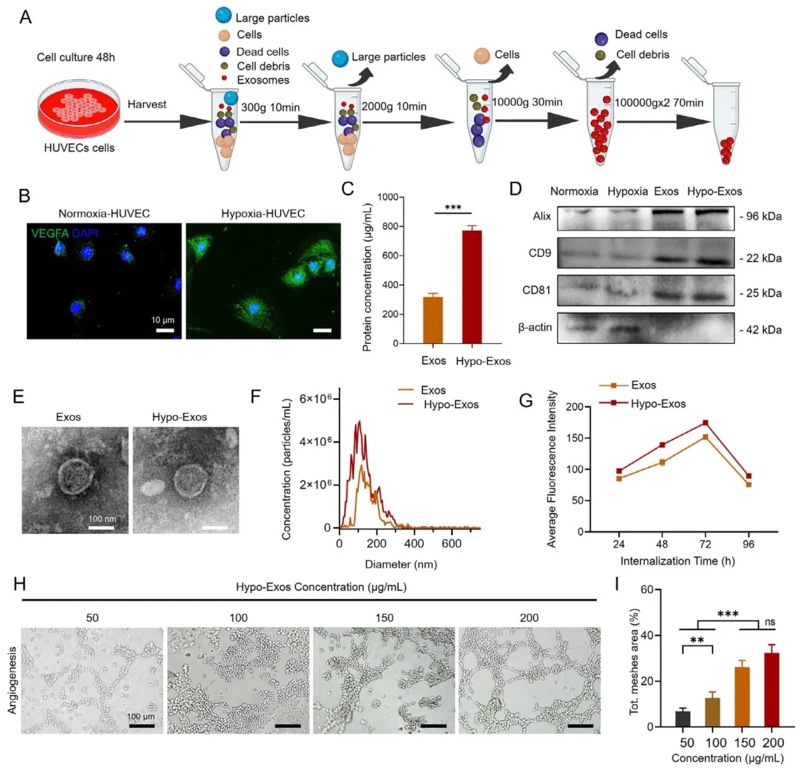
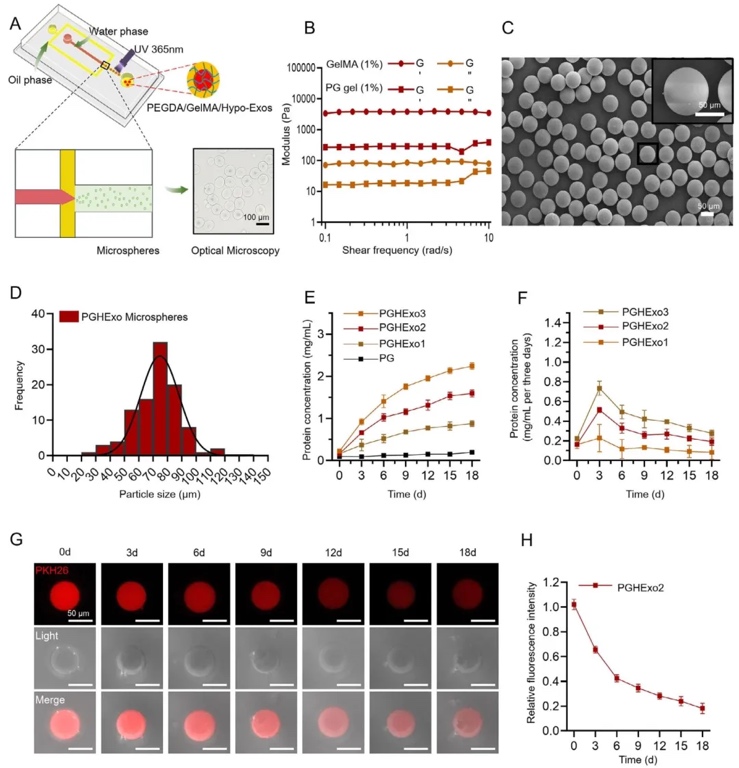
3. 低氧誘導外泌體(HExo)的提取與表征,通過多步超速離心從低氧培養的HUVECs中分離外泌體,利用TEM、納米顆粒跟蹤分析(NTA)及Western blot檢測,結果顯示HExo呈球形、粒徑約100 nm,低氧條件下VEGFA表達及蛋白濃度顯著高于常氧組,且對HUVECs的促血管形成能力呈劑量依賴性(200 μg/mL時血管網絡面積最大)。
4. PEGDA/GelMA水凝膠微球(PGHExo)的制備與釋放特性,利用微流控芯片技術制備平均粒徑80 μm的雙網絡水凝膠微球,通過流變學測試證實其儲能模量(G′)高于單一GelMA凝膠,體外釋放實驗顯示HExo呈持續釋放模式(18天累計釋放率約80%),熒光追蹤顯示微球在體內外均能穩定釋放外泌體達4周以上。
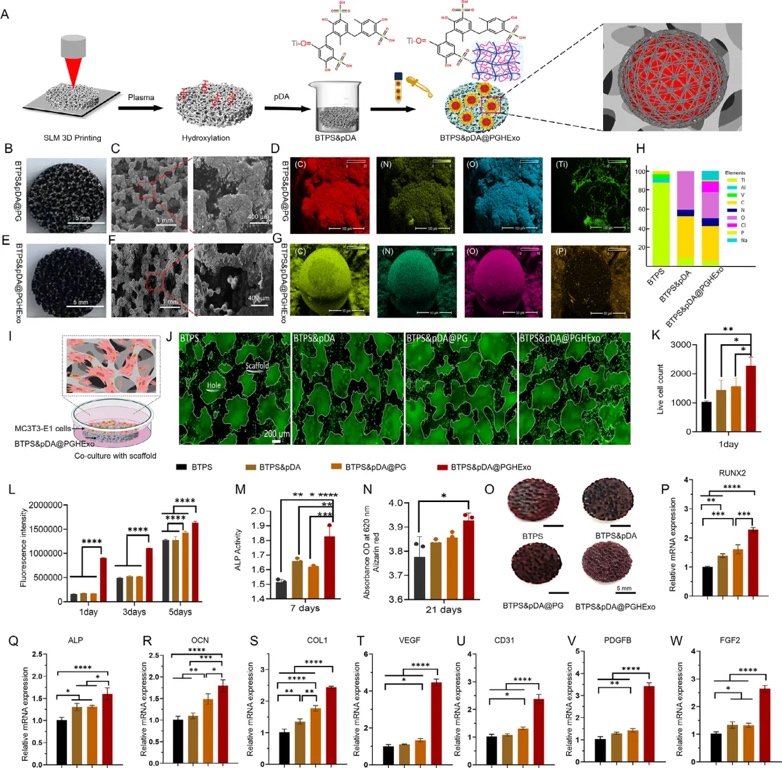
5. 支架表面改性與體外生物相容性評估,通過聚多巴胺(pDA)涂層將PGHExo錨定至BTPS表面,SEM顯示微球均勻分布,EDS檢測到C/N/O/P元素證實微球成功結合。活/死細胞染色顯示BTPS&pDA@PGHExo組MC3T3-E1細胞存活率顯著高于對照組,ALP活性及茜素紅礦化結節形成量均最優,RT-PCR顯示成骨基因(RUNX2/ALP/OCN)和血管生成基因(VEGF/CD31)表達顯著上調。
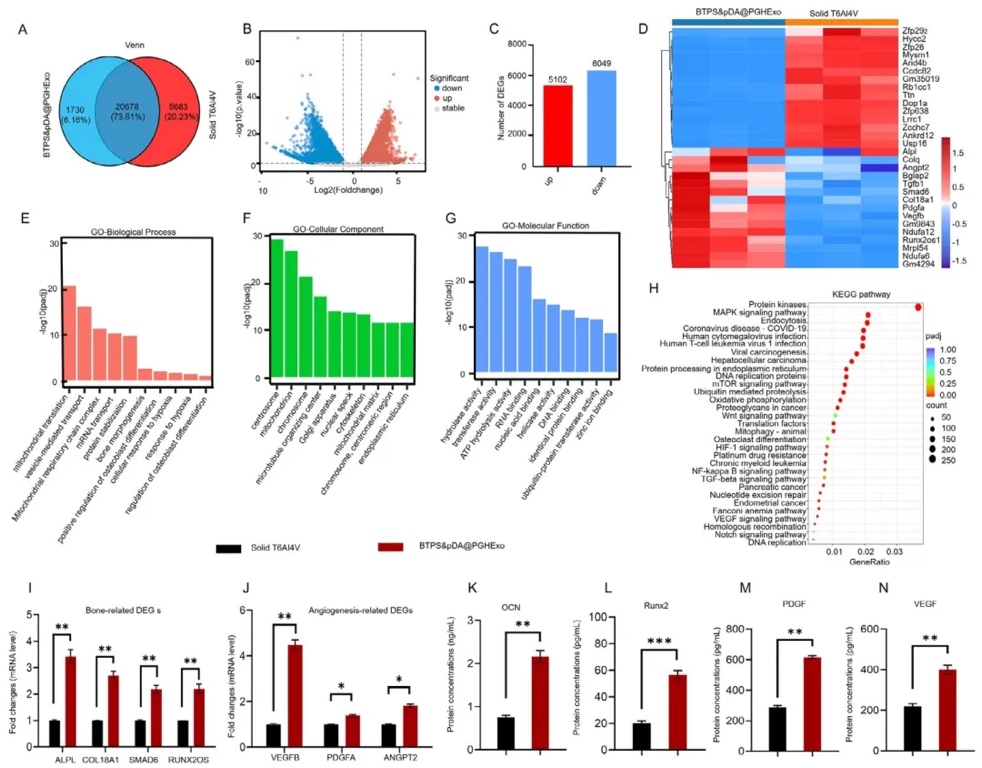
6. 支架誘導骨再生的轉錄組學機制分析,通過mRNA-seq對比BTPS&pDA@PGHExo與純鈦支架組的基因表達,GO富集分析顯示差異基因顯著富集于“骨骼發育”“血管生成”“MAPK/mTOR/HIF-1信號通路”,RT-PCR及ELISA驗證ALPL、VEGFB等關鍵基因和蛋白(RUNX2/VEGF)的上調,揭示外泌體通過激活多通路協同促進骨再生。
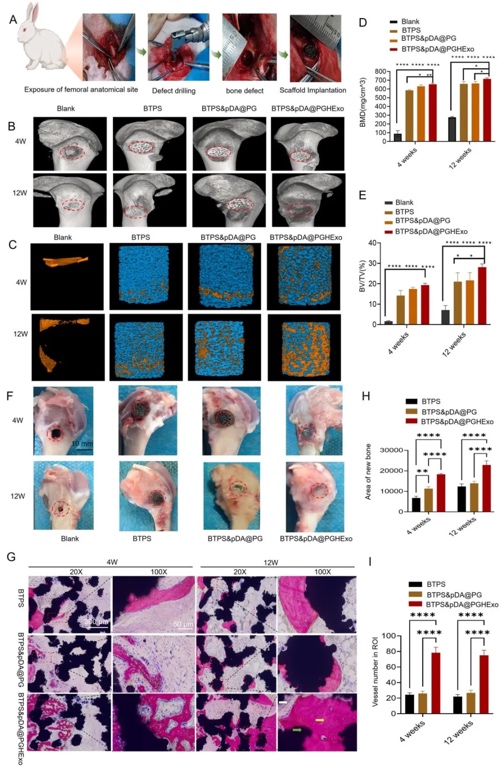
7. 兔股骨缺損模型的體內修復效果,通過顯微CT(μCT)和組織學染色(亞甲藍-品紅)評估,結果顯示BTPS&pDA@PGHExo組在12周時新骨體積(28.1 mm³)和骨密度(717.1 mg/cm³)顯著高于對照組,新生血管密度及成熟骨小梁結構形成量最優,證實其通過結構仿生與外泌體緩釋的雙重作用實現功能性骨再生。
研究結論
本研究開發了一種雙重仿生策略,將3D打印鈦小梁支架與低氧誘導外泌體緩釋系統結合,用于促進血管化骨再生。通過Voronoi算法設計的仿生小梁結構(孔隙率70%,彈性模量3.2 GPa)有效模擬天然骨的力學性能,聚多巴胺修飾的水凝膠微球實現外泌體的持續釋放(體外≥30天)。體外實驗表明,該支架顯著促進成骨細胞分化(ALP活性提升2.3倍,礦化結節面積增加45%)和血管內皮細胞網絡形成(VEGF表達上調5.8倍)。體內兔股骨缺損模型顯示,植入12周后新骨體積達28.1 mm³,骨密度恢復至正常骨的89%,且新生血管密度是單純支架組的3.2倍。轉錄組學證實,該體系通過激活MAPK、mTOR和HIF-1信號通路協同調控成骨與血管生成。本研究為解決大段骨缺損修復中的力學不匹配和血管化不足提供了新范式,展現出個性化骨再生治療的臨床轉化潛力。
文章來源:
https://advanced.onlinelibrary.w ... 1002/advs.202500599
(責任編輯:admin)


 3D打印硅酸鍶誘導神經干細
3D打印硅酸鍶誘導神經干細 航空航天晶格結構增材制造
航空航天晶格結構增材制造 3D NASA資助!Systems與高
3D NASA資助!Systems與高 卡爾伊利諾伊醫學院團隊開
卡爾伊利諾伊醫學院團隊開 GKN Aerospace集成 AM Exp
GKN Aerospace集成 AM Exp 突破性生物3D打印
突破性生物3D打印 迪拜LEAP 71公司
迪拜LEAP 71公司 3D生物打印構建內
3D生物打印構建內 《Small Science
《Small Science 南洋理工-劍橋大
南洋理工-劍橋大 清華大學:抗拉強
清華大學:抗拉強

