3D打印助力!構建“精密”腫瘤轉移模型
時間:2019-02-18 13:35 來源:南極熊 作者:中國3D打印網 閱讀:次
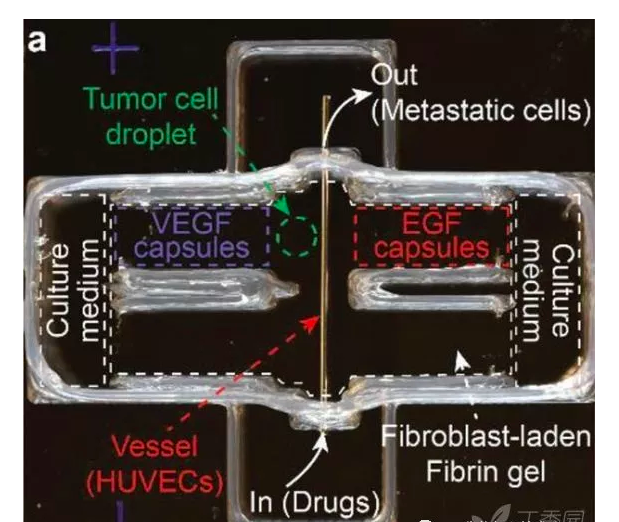
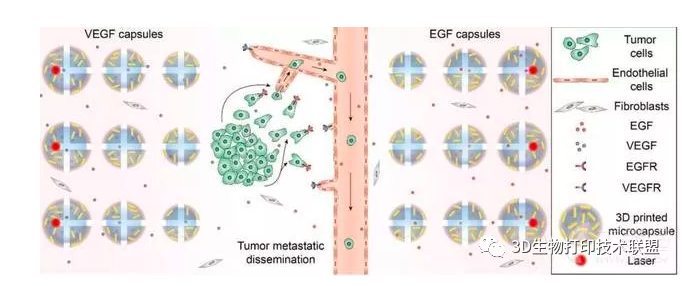
▲3D打印的體外腫瘤模型,模擬腫瘤細胞的轉移。3D打印的可編程膠囊梯度釋放EGF和VEGF,介導腫瘤細胞對腫瘤基質的侵襲和血管內滲入。EGF:表皮生長因子; VEGF:血管內皮生長因子; EGFR:EGF受體;VEGFR:VEGF受體。
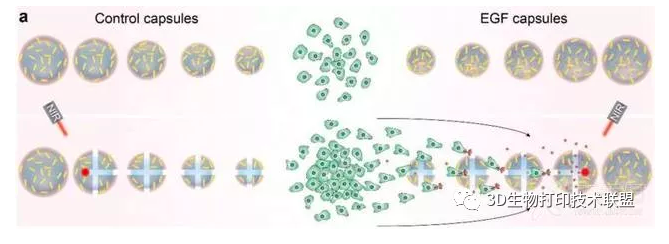
▲膠囊釋放的EGF可用于引導腫瘤細胞遷移。大多數腫瘤細胞(A549肺癌細胞)僅在EGF膠囊區域中發現并且隨著更多膠囊破裂而增加。
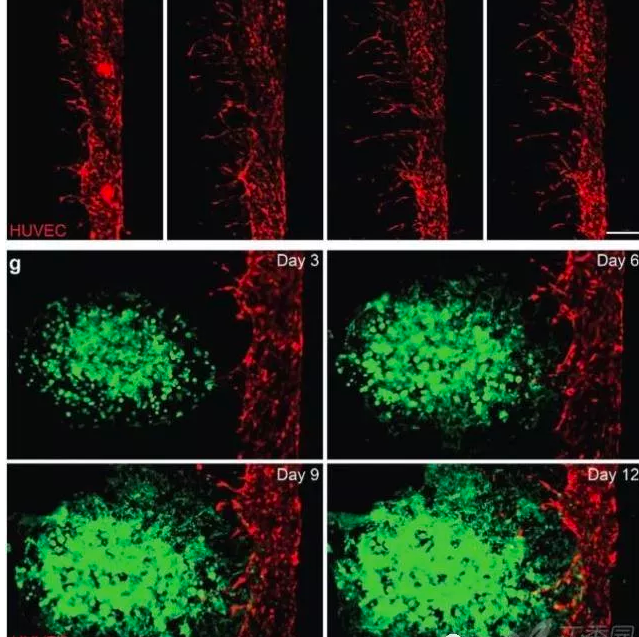
▲VEGF膠囊誘導主血管出芽,A549細胞進入脈管系統。
滲透到血管中的腫瘤細胞作為CTCs在血管流動,并且可以在獨立的腔室內被收集。可以對富集的CTCs進行特異性分析。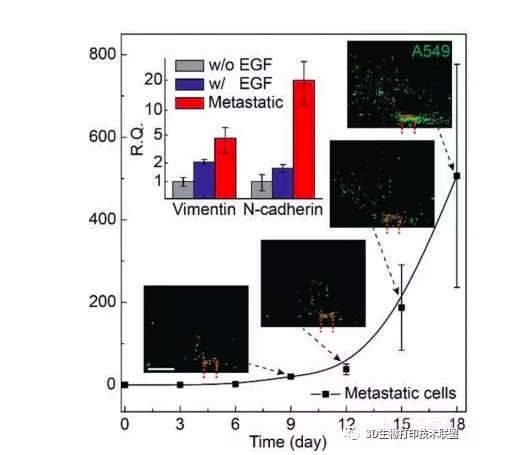
▲在富集的A549肺癌細胞中,波形蛋白和N-鈣粘蛋白上調。
該3D生物打印腫瘤模型可作為藥物篩選的臨床前工具。通過血管引入兩種免疫毒素藥物EGF4KDEL和CD22KDEL。EGF4KDEL由EGF和截短的假單胞菌外毒素組成,靶向EGFR過表達的A549腫瘤細胞。與無藥物治療組相比,腫瘤細胞的增殖顯著減少,并且未觀察到引導入侵和遷移。由于A549不表達CD22,它們不受CD22KDEL的影響,表現出快速增殖和引導入侵。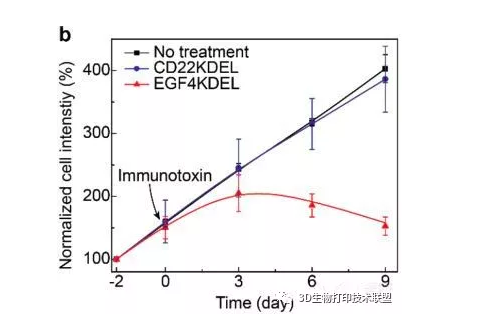
▲利用該模型進行藥物篩選
盡管這種模型并不能完全概括體內腫瘤微環境的復雜性,但其極大化地縮短了傳統2D單層細胞培養和動物模型之間的差距。同時推進了3D組織工程研究。該研究團隊的下一步計劃是加入更多的細胞類型,特別是免疫系統細胞,并研究這些細胞之間的相互作用。
(責任編輯:admin)
最新內容
熱點內容


 Axial3D 與 GE HealthCare
Axial3D 與 GE HealthCare 3D打印魚肉即將在新加坡及
3D打印魚肉即將在新加坡及 美女在TikTok上展示自己購
美女在TikTok上展示自己購 Signify通過3D打印技術打
Signify通過3D打印技術打 組織損傷原位定制化修復的
組織損傷原位定制化修復的 3D打印使宜家家具個性化
3D打印使宜家家具個性化 3D打印實現外固定
3D打印實現外固定 哥倫比亞大學采用
哥倫比亞大學采用 失去1/3掌面,浙大
失去1/3掌面,浙大 3D打印軟皮墊增強
3D打印軟皮墊增強 3D打印替換患病脊
3D打印替換患病脊 功能材料新“大門
功能材料新“大門

