3D打印Janus異質微球精準控釋實現全周期調控骨再生(2)
時間:2024-08-27 08:43 來源: EngineeringForLife 作者:admin 閱讀:次
3.Janus異質微球實現精準免疫調控
各組Janus異質微球與巨噬細胞RAW264.7共培養后,早期高濃度鈣離子的釋放(Fast組)將驅使巨噬細胞向M1表型極化,而低濃度緩慢釋放CPO(Delayed組和Sequence組)則能促進M2型巨噬細胞分化(圖3 A-F),抑制促炎因子TNF-a,并促進抗炎因子IL-10的分泌(圖3 G)。RNA-seq結果進一步提示,該免疫調控過程可能通過激活JAK-STAT信號通路,優化了骨免疫微環境,加速了血管化及礦化過程(圖3 H-L)。
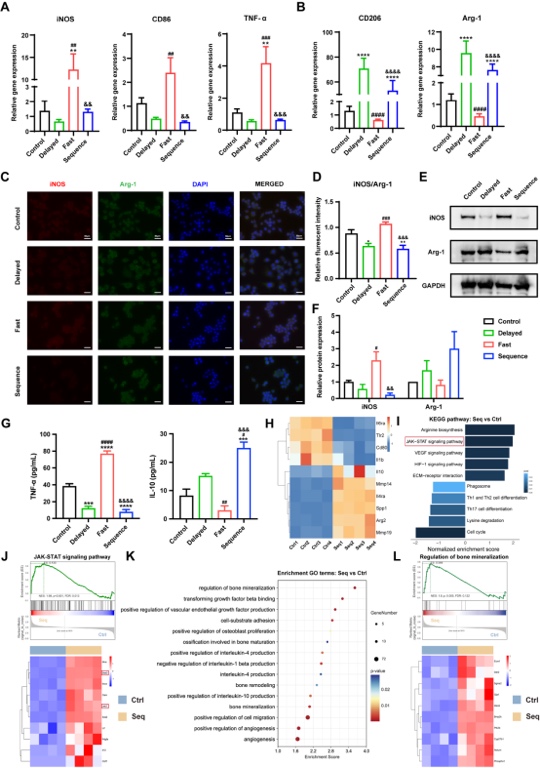
圖3 Janus異質微球的免疫調控能力
4.Janus異質微球靶向調控骨再生序列事件
各組Janus異質微球與骨髓間充質干細胞BMSC共培養后,各組細胞增殖及活性良好(圖4 A、B),負載雙因子的Janus異質微球的成骨活性顯著高于無因子負載的純GelMA組(Control組),特別地,Fast組和Sequence組表現出最為優異的成骨潛能(圖4 C-I),這可能與初期相對高濃度釋放BMP-2有關,同時,持續緩慢的CPO釋放也為晚期礦化過程提供了充足的鈣磷原料。RNA-seq結果進一步提示,Sequence組能上調愈合過程中早期、中期及晚期成骨相關基因(圖4 J),激活骨再生序列事件中的多個生物學行為及信號通路(圖4 K、L),實現對骨修復過程的全周期調控。
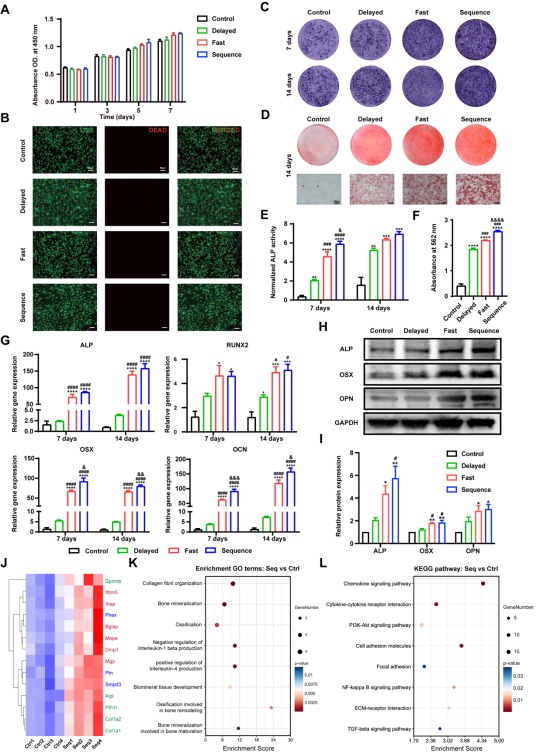
圖4 Janus異質微球的成骨性能
5.Janus異質微球通過優化體內骨免疫微環境實現高效骨再生
為進一步評估Janus異質微球的體內免疫調控及促骨再生行為,研究人員首先將各組微球植入至大鼠皮下,術后3、7天后,進行巨噬細胞免疫熒光染色,結果顯示,所有組別中均存在不同程度的巨噬細胞(F4/80+)包裹,與體外結果一致的是,早期低濃度釋放CPO的Delayed組和Sequence組,具有較高比例的F4/80+CD206+細胞,而Fast組中微球周圍則出現大量的F4/80+CD86+細胞,這意味著Janus異質微球的不同控釋行為能精準調控體內免疫微環境,持續低濃度鈣離子的釋放有助于創造利于成骨的抗炎微環境(圖5)。將各組微球植入至大鼠顱骨缺損后,Sequence組實現了最高效的骨愈合,術后8周后在微球間觀察到大量的新生骨,較其他組別更為成熟,且有完整的骨橋連接,這一現象得益于BMP-2在微球控釋系統的高效按需釋放,及CPO的持續性釋放,既有利于早期免疫調控,也為晚期的骨基質礦化成熟提供了有利條件。
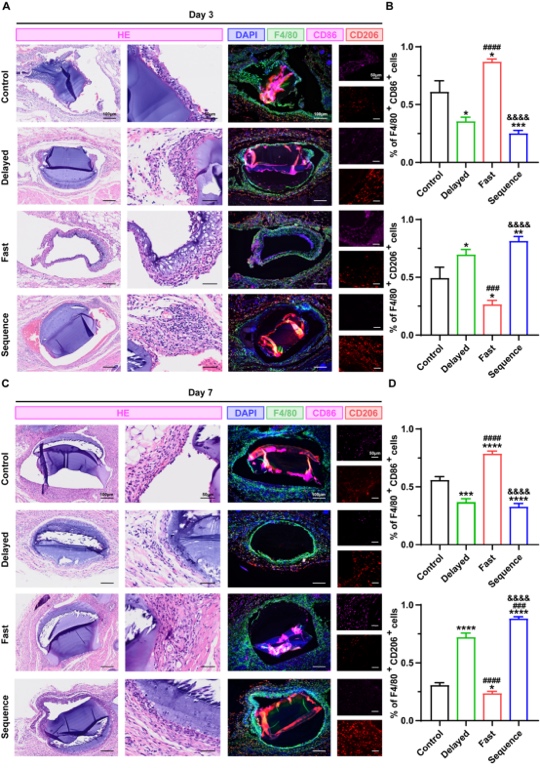
圖5 Janus異質微球的體內免疫調控能力

圖6 Janus異質微球的體內成骨能力的影像學評估
圖7 Janus異質微球的體內成骨能力的組織學評估
綜上,該項工作基于Bottom up骨修復理念,通過采用性能高度可調的GelMA水凝膠,實現對雙重活性成分的靈活控釋,靶向骨再生序列階段,完成高效骨修復。該策略充分挖掘了GelMA水凝膠固有的理化性能,實現對復雜生物學過程的精準調控,過程中無更多化學成分的添加,為通用性綠色載藥控釋平臺的構建提供了新思路,也為臨床轉化提供了優良的前提條件。
文章來源:
https://doi.org/10.1002/smll.202403835
(責任編輯:admin)
最新內容
熱點內容


 649美元!Revopoint全新Me
649美元!Revopoint全新Me 649美元!Revopoint全新Re
649美元!Revopoint全新Re 蘇黎世聯邦理工學院推出采
蘇黎世聯邦理工學院推出采 貴州首例!貴州醫附院骨科
貴州首例!貴州醫附院骨科 浙江省人民醫院/浙江大學
浙江省人民醫院/浙江大學 ADNOC Gas使用3D打印按需
ADNOC Gas使用3D打印按需 哥倫比亞大學采用
哥倫比亞大學采用 失去1/3掌面,浙大
失去1/3掌面,浙大 3D打印軟皮墊增強
3D打印軟皮墊增強 3D打印替換患病脊
3D打印替換患病脊 功能材料新“大門
功能材料新“大門 老牌運動品牌Jack
老牌運動品牌Jack

