中國人民解放軍總醫院:3D生物打印M2巨噬細胞外囊泡模擬物促進血管再生
3D生物打印組織移植物在再生醫學中具有廣闊前景,但其臨床轉化面臨兩大核心挑戰:一是植入后引發的異物反應(FBR),導致纖維包膜形成和炎癥持續,阻礙移植物與宿主組織整合;二是血管化不足,造成移植物缺氧和功能障礙。研究表明,生物材料的剛度會誘導巨噬細胞向促炎的M1表型極化,加劇FBR,而傳統細胞療法存在存活難、倫理風險及成本高等問題。
為解決上述難題,中國人民解放軍總醫院的付小兵院士、杜曉輝主任和黃沙教授開發了一種基于M2巨噬細胞源細胞外囊泡模擬物(M2-EVMs)的創新策略。團隊通過膜擠壓技術制備了M2-EVMs,將其作為生物墨水添加劑融入3D打印支架中,利用M2-EVMs抑制M1極化、促進M2極化及血管生成的特性,減輕FBR并增強組織再生能力。在皮下植入和皮膚傷口模型中,搭載M2-EVMs的3D打印支架顯著減少了纖維包膜厚度,提升了血管密度和傷口愈合效率,展現出良好的生物相容性和再生效果。
相關工作以“Bioprinted M2 macrophage-derived extracellular vesicle mimics attenuate foreign body reaction and enhance vascularized tissue regeneration”為題發表在《Biofabrication》上。


研究內容
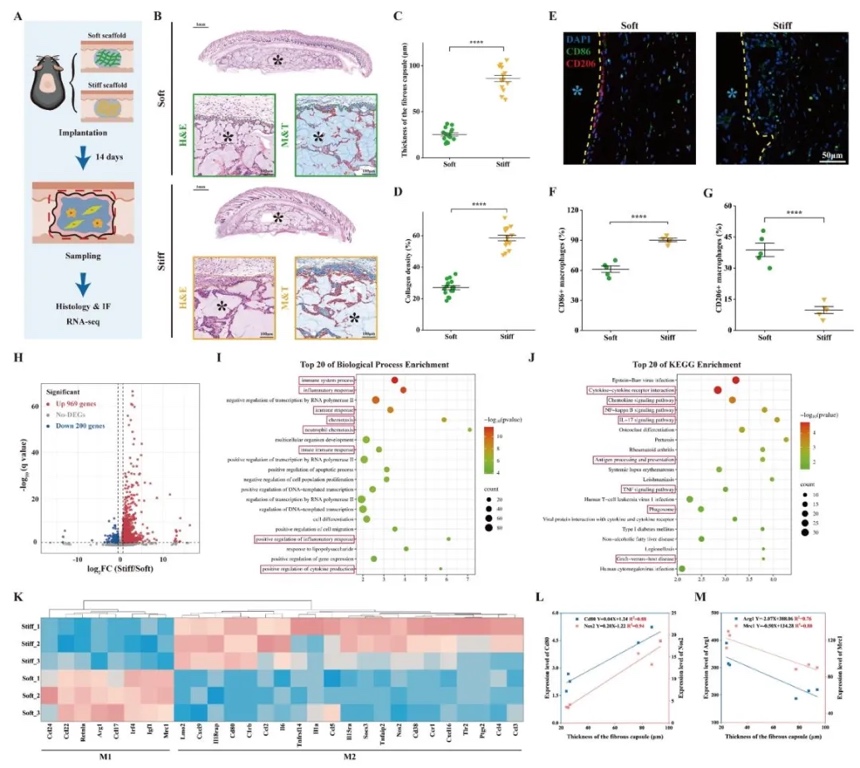
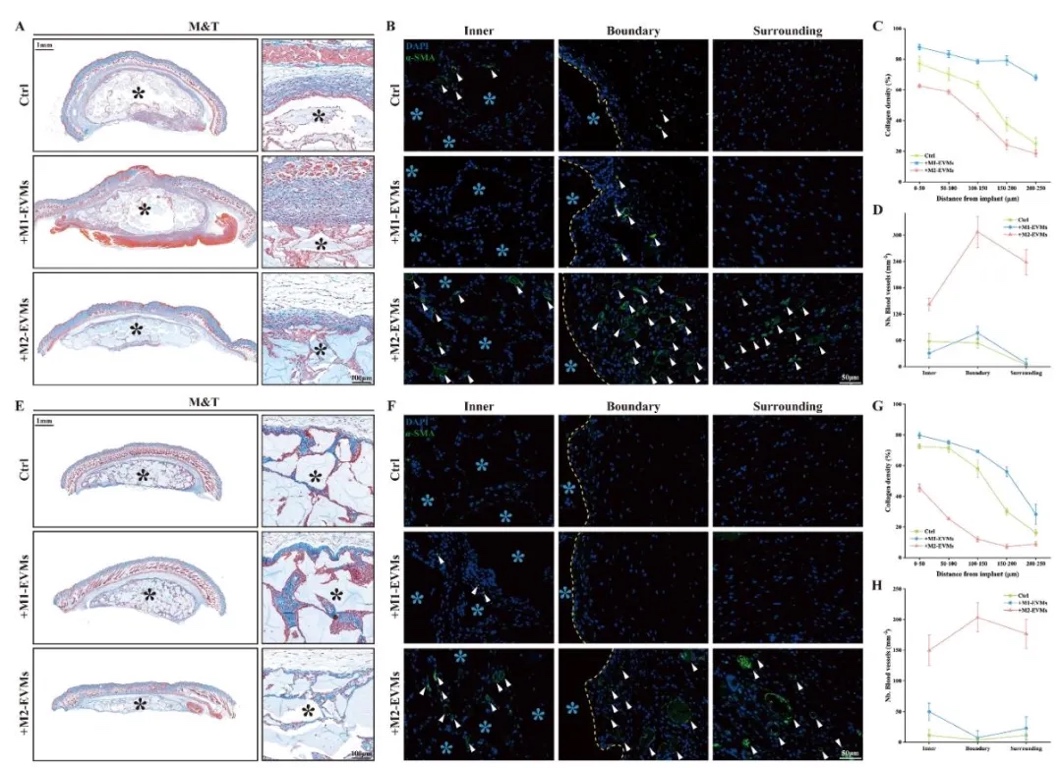
1. 3D生物打印支架剛度對異物反應的影響,通過皮下植入不同剛度的3D生物打印支架,結合H&E染色、免疫熒光及轉錄組測序,研究支架剛度與異物反應(FBR)及巨噬細胞極化的關系。結果表明,硬支架(Young’s模量0.285 MPa)顯著誘導M1巨噬細胞極化(CD86+比例達80%),纖維包膜厚度(164.7±44.2 µm)是軟支架的3倍,且促炎基因(如IL-6、TLR4)顯著上調,證實剛度通過加劇M1極化惡化FBR。
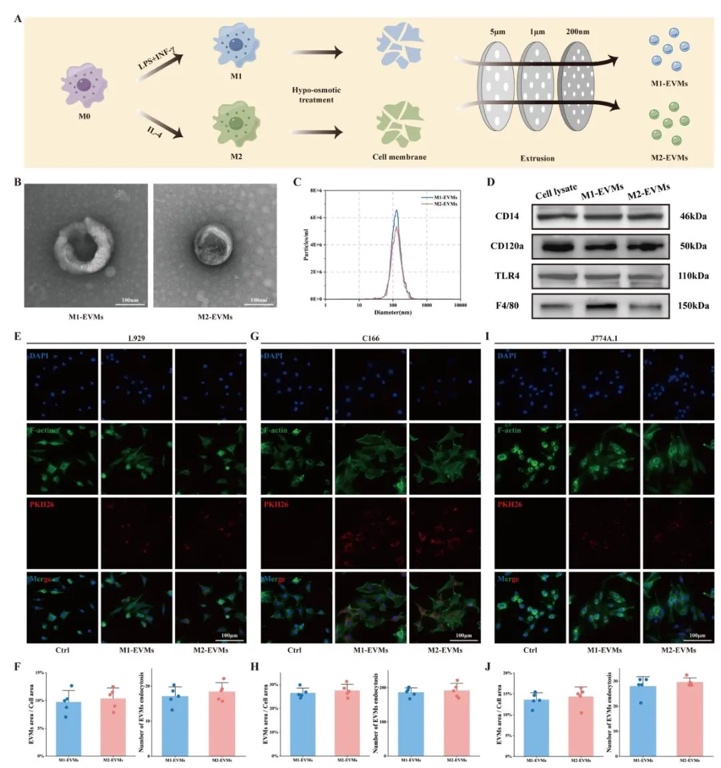
2. M2巨噬細胞源細胞外囊泡模擬物(M2-EVMs)的制備與表征,利用膜擠壓技術結合超聲破碎和梯度離心,制備了M1/M2-EVMs,并通過HR-TEM、NTA及蛋白質印跡分析其結構和成分。結果顯示,M2-EVMs呈圓形囊泡結構(粒徑約100 nm),高表達M2標記蛋白(如CD206、Arg1),低表達促炎蛋白(如TLR4),且能被成纖維細胞、內皮細胞和巨噬細胞有效攝取(6 h內攝取率>70%)。
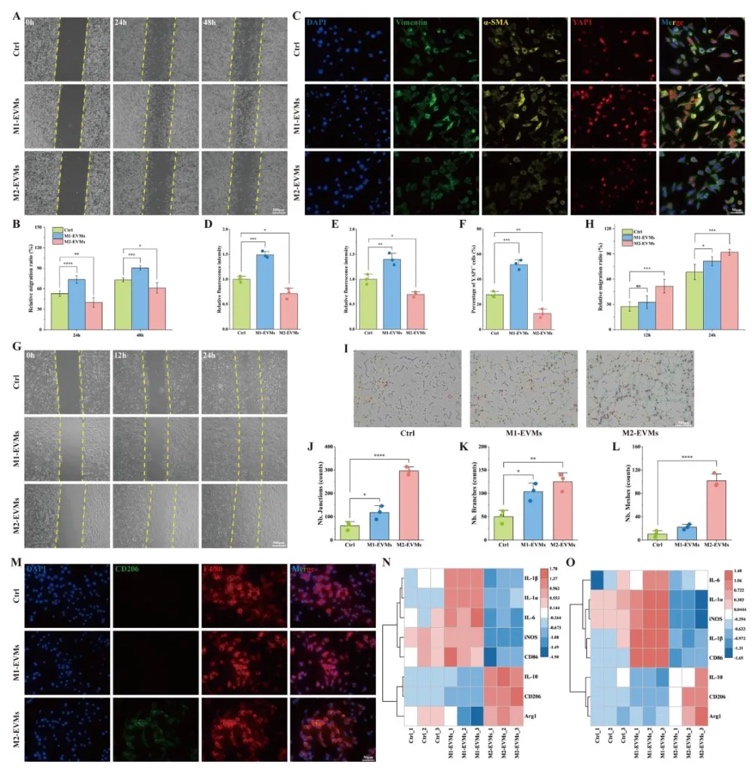
3. M2-EVMs對體外細胞行為的調控作用,通過劃痕實驗、管形成實驗及RT-qPCR,研究了M2-EVMs對成纖維細胞、內皮細胞及巨噬細胞的功能影響。結果表明,M2-EVMs顯著抑制成纖維細胞活化(α-SMA表達降低50%)和遷移,促進內皮細胞血管生成(管形成數量增加80%),并誘導巨噬細胞向M2表型極化(CD206+比例從10%升至45%),而M1-EVMs作用相反。
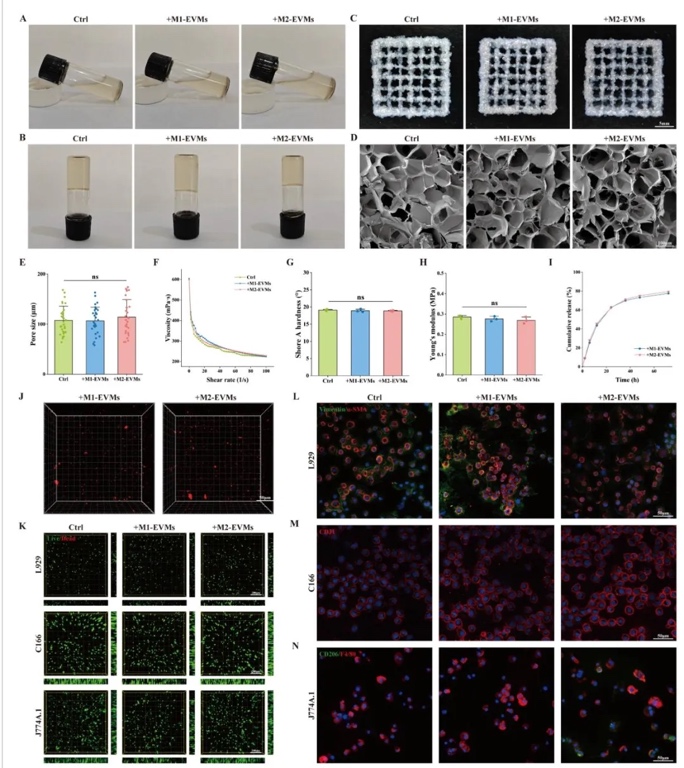
4. 生物墨水特性與EVMs釋放行為,通過流變學測試、SEM及釋放曲線分析,研究了含EVMs的明膠-海藻酸鹽水凝膠墨水的打印適性和釋放特性。結果表明,EVMs添加未顯著改變墨水的剪切變稀特性(黏度≈1000 mPa·s)和機械性能(Shore A硬度18.8-19.1°),且能在72 h內持續釋放(累積釋放率≈80%),均勻分布于支架孔隙中。
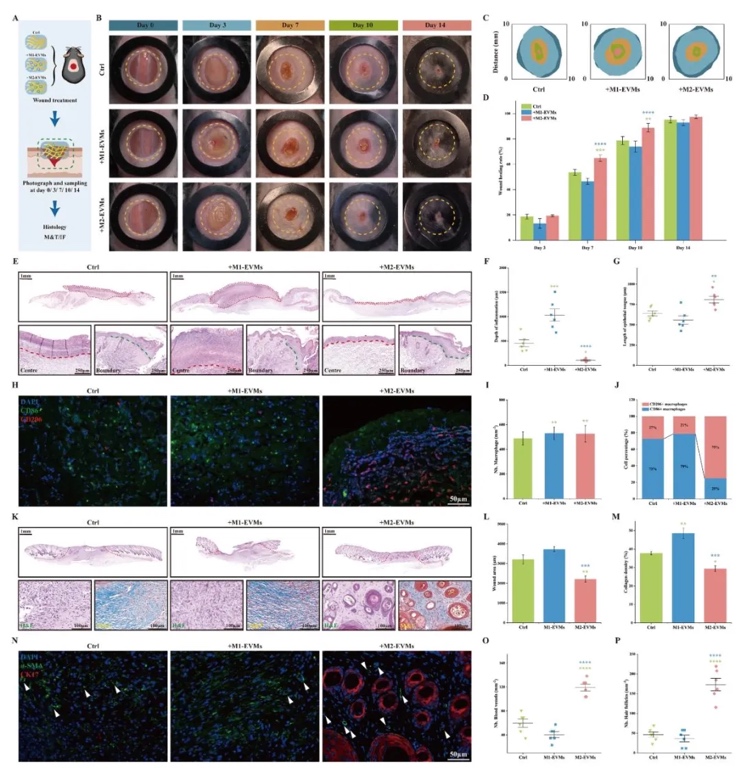
5. 含M2-EVMs的3D生物打印支架的體內性能評估,通過皮下植入和全層皮膚傷口模型,結合H&E染色、Masson染色及免疫熒光,研究了M2-EVMs對FBR和組織再生的影響。結果顯示,搭載M2-EVMs的硬支架纖維包膜厚度僅26.7±7.6 µm(較對照組降低58%),血管密度增加3倍,傷口愈合率提升40%,并促進毛囊和血管再生,而M1-EVMs組炎癥反應加劇。

研究結論
本研究開發了一種基于M2巨噬細胞源細胞外囊泡模擬物(M2-EVMs)的3D生物打印策略,以解決3D打印組織移植物的異物反應(FBR)和血管化不足問題。通過膜擠壓技術制備的M2-EVMs可抑制巨噬細胞向促炎M1表型極化,促進血管生成相關因子分泌,并有效被成纖維細胞、內皮細胞攝取。將其作為生物墨水添加劑融入明膠-海藻酸鹽支架后,未顯著改變墨水的機械性能和打印適性,且能持續釋放(72 h累積釋放率≈80%)。體內實驗表明,搭載M2-EVMs的支架可使纖維包膜厚度降低58%,血管密度增加3倍,顯著促進皮膚傷口的上皮化、毛囊再生及血管形成。本研究證實M2-EVMs通過調控免疫微環境和促進血管化,顯著提升了3D打印組織的宿主整合能力,為解決生物材料植入后的炎癥和再生難題提供了新途徑。
文章來源:
https://doi.org/10.1088/1758-5090/add49f
(責任編輯:admin)


 蘇黎世聯邦理工學院揭幕To
蘇黎世聯邦理工學院揭幕To 雙仿生策略,3D打印支架攜
雙仿生策略,3D打印支架攜 伊利諾伊研究人員發現,每
伊利諾伊研究人員發現,每 當古老水城遇見未來科技,
當古老水城遇見未來科技, Nature子刊:韓國研究團隊
Nature子刊:韓國研究團隊 突破性生物3D打印
突破性生物3D打印 迪拜LEAP 71公司
迪拜LEAP 71公司 3D生物打印構建內
3D生物打印構建內 《Small Science
《Small Science 南洋理工-劍橋大
南洋理工-劍橋大 清華大學:抗拉強
清華大學:抗拉強

