基于多材料投影光固化生物3D打印機,3D打印細胞自組裝血管
時間:2023-01-10 10:12 來源:EngineeringForLife 作者:admin 閱讀:次
血管化不僅是器官發生、組織形成和維持所必需的,而且是愈合和再生的關鍵,在血管化不足阻礙愈合的情況下,生物工程技術可以通過增強促進再生與血管形成相關的基本細胞機制。快速血管化是充分提供營養、氧氣和信號因子以及轉運代謝產物的關鍵。所有這些必要的過程可確保細胞存活并防止更大組織或器官中壞死核心的發展。遺憾的是,模擬組織和微血管的生理復雜性,包括細胞排列和細胞外基質(ECM)相互作用,仍然是體外方法的一個挑戰。不同組織的血管系統以特定的血管模式為特征,不同組織的血管模式差異很大。因此,控制血管形成的獨特模式過程對于生物工程生理供應和確保組織的總體功能是必不可少的。
近期,Berlin Institute of Health at Charité 的Isabel Orellano在AFM上發表了題為“Engineering Vascular Self-Assembly by Controlled 3D-Printed Cell Placement”的文章,報道了一種使用基于多材料投影立體光刻生物3D打印機和一種創新的生物材料系統來控制微血管結構的幾何形狀。在該框架內,HUVECs、hMSCs和人真皮成纖維細胞(hdFs)作為支持細胞類型相互作用,研究其血管生成和血管生成行為。
生物3D打印以特殊設計的方式將細胞和生物相容性材料結合起來,為設計血管化結構提供了機會。然而,微血管動態網絡的復雜性仍然難以通過復雜的3D制造重現。理想情況下,可利用內皮細胞的天然組織能力,使工程血管網絡自我組裝,形成復雜、可控的微血管模式。研究人員提出了一種生物工程的方法來控制微血管結構的形成,并引導內皮細胞和支持細胞在多材料光固化打印結構中實現自我組裝。生物工程血管化結構是通過受控的細胞沉積在酶可降解或不可降解的材料中產生的。在體外,微血管結構在分布、血管網方向、血管長度和分支行為、發育的管腔、血管穩定的跡象和包括吻合在內的相互連接的血管網中受到調節。這種新型的生物構建方法展示了通過使用細胞和空間線索來生成清晰而精確的血管化結構來控制微血管網絡形成的能力。這種控制微血管形成的新方法可能在血管化植入物或體外篩選模型的開發中發揮基本作用。
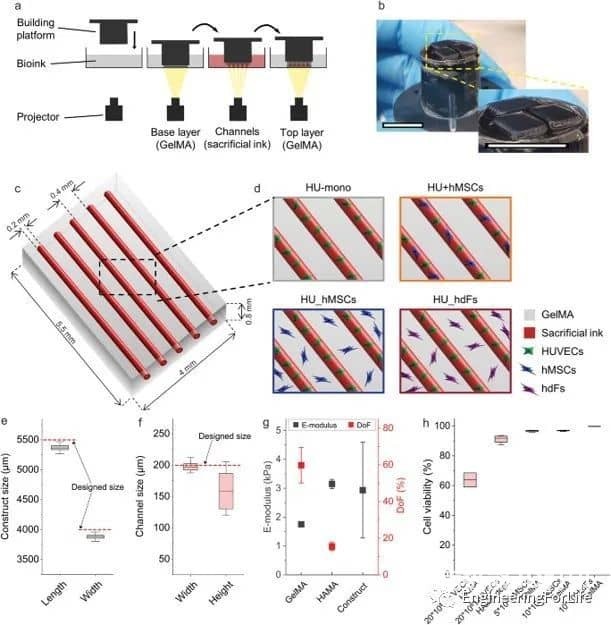
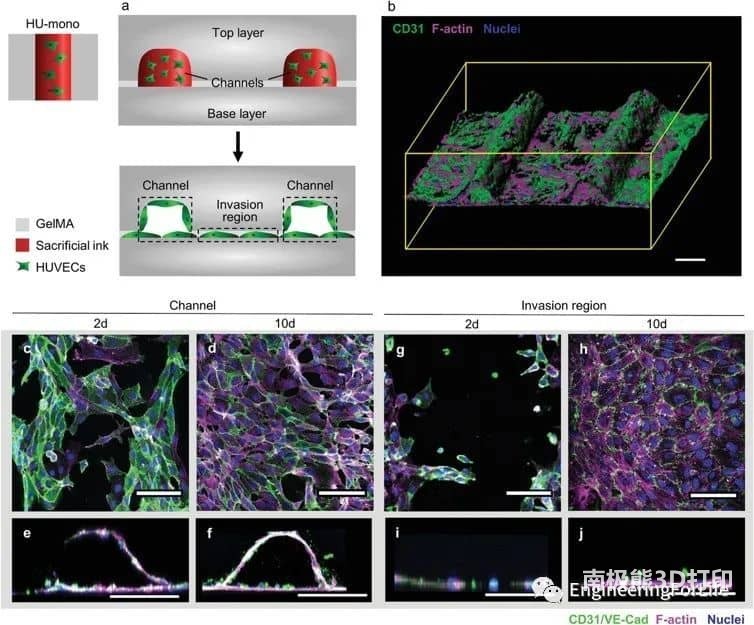
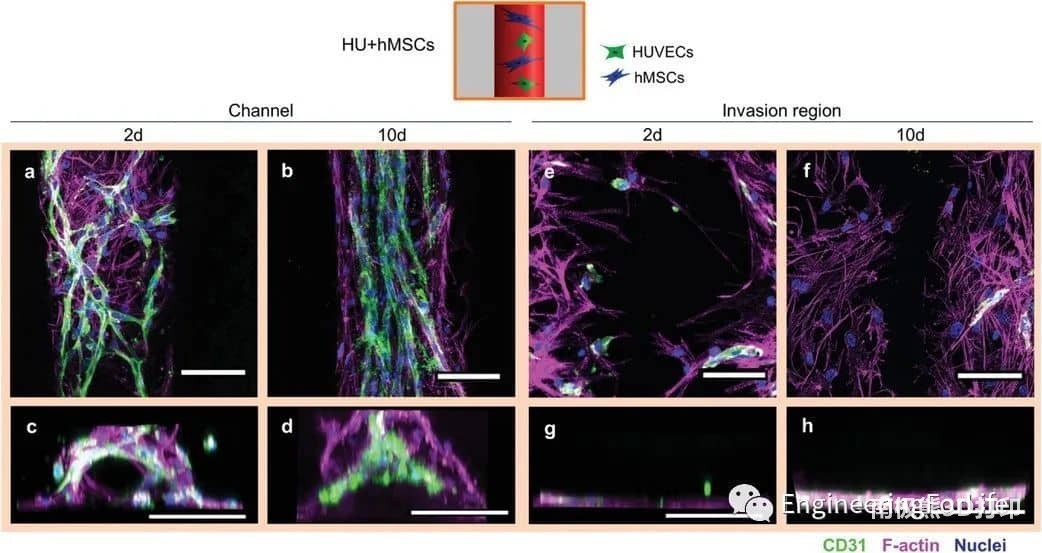
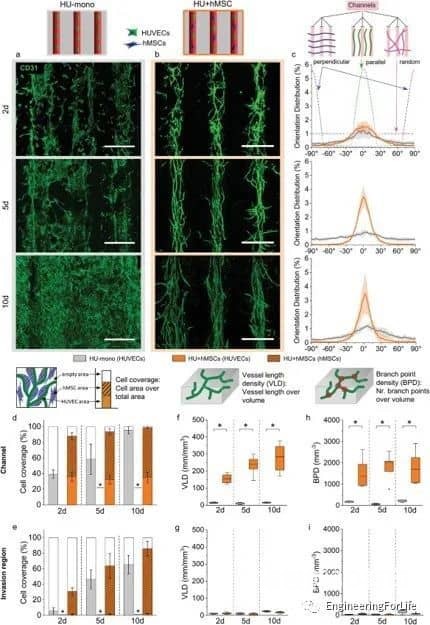
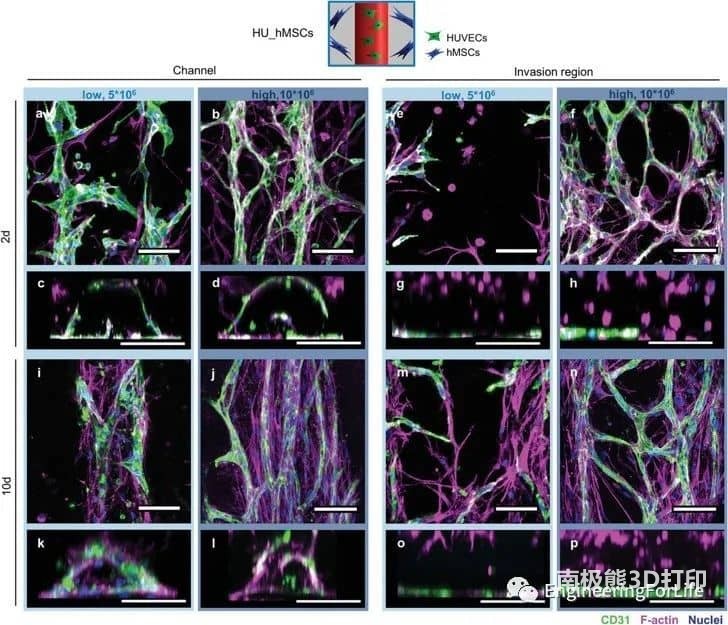
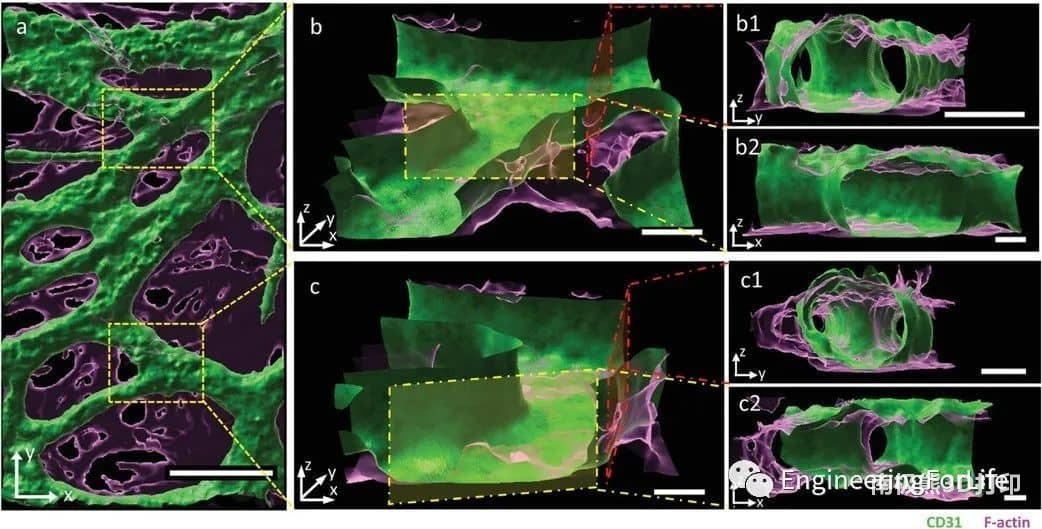
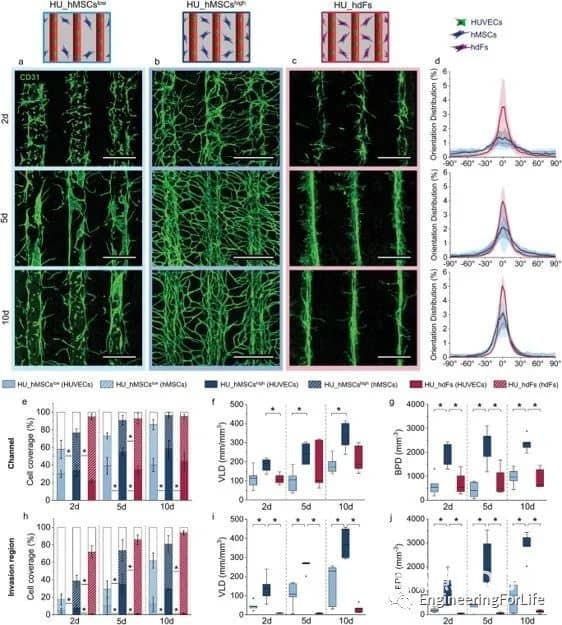
該系統允許通過內皮襯里生成大血管通道,以及通過調節生物打印設置(即通過改變細胞位置、實體和劑量),通過細胞自組裝過程形成可控的微血管結構。通過改變支持細胞的類型和位置,可以誘導和調節血管結構的形成。摻入細胞在培養數天內即可形成有管腔的微血管結構,并表現出穩定和成熟的跡象,并通過血管生成和吻合形成相互連接的血管網絡。綜上所述,研究人員通過設計不同的細胞空間排列來控制形成的血管結構的數量、方向、長度和分支行為,從而控制細胞間的相互作用、遷移和增殖,從而研究細胞類型和空間配置如何影響宏觀和微觀血管結構的自組裝。這種將細胞自組裝的能力與血管形成的空間控制相結合的創新策略允許發展獨特而精確的血管化。考慮到組織工程和再生療法的潛在用途,通過自組織形成的血管結構應優于人工生成的血管結構。這項工作代表了通過改變細胞類型和位置,通過細胞自組裝來形成和調節微血管結構的系統研究。
文章來源:
https://doi.org/10.1002/adfm.202208325
近期,Berlin Institute of Health at Charité 的Isabel Orellano在AFM上發表了題為“Engineering Vascular Self-Assembly by Controlled 3D-Printed Cell Placement”的文章,報道了一種使用基于多材料投影立體光刻生物3D打印機和一種創新的生物材料系統來控制微血管結構的幾何形狀。在該框架內,HUVECs、hMSCs和人真皮成纖維細胞(hdFs)作為支持細胞類型相互作用,研究其血管生成和血管生成行為。
生物3D打印以特殊設計的方式將細胞和生物相容性材料結合起來,為設計血管化結構提供了機會。然而,微血管動態網絡的復雜性仍然難以通過復雜的3D制造重現。理想情況下,可利用內皮細胞的天然組織能力,使工程血管網絡自我組裝,形成復雜、可控的微血管模式。研究人員提出了一種生物工程的方法來控制微血管結構的形成,并引導內皮細胞和支持細胞在多材料光固化打印結構中實現自我組裝。生物工程血管化結構是通過受控的細胞沉積在酶可降解或不可降解的材料中產生的。在體外,微血管結構在分布、血管網方向、血管長度和分支行為、發育的管腔、血管穩定的跡象和包括吻合在內的相互連接的血管網中受到調節。這種新型的生物構建方法展示了通過使用細胞和空間線索來生成清晰而精確的血管化結構來控制微血管網絡形成的能力。這種控制微血管形成的新方法可能在血管化植入物或體外篩選模型的開發中發揮基本作用。

圖1 3D生物打印血管化結構的實驗設置

圖2 HUVECs (HU‐mono)通過內皮襯里形成大血管通道情況下的細胞行為

圖3 HUVECs與hMSCs在通道內近距離排列(HU+hMSCs組)。

圖4 隨著第二種細胞類型的加入而形成的結構化微血管網

圖5 不同hMSC濃度(HU_hMSCslow和HU_hMSCshigh)局部打印的HUVECs(綠色)和hMSCs(品紅)的細胞行為相互分離

圖6 不同角度的互聯血管網絡共聚焦圖像

圖7 通過改變細胞的位置、hMSCs的濃度和細胞類型來調節微血管結構的形成
該系統允許通過內皮襯里生成大血管通道,以及通過調節生物打印設置(即通過改變細胞位置、實體和劑量),通過細胞自組裝過程形成可控的微血管結構。通過改變支持細胞的類型和位置,可以誘導和調節血管結構的形成。摻入細胞在培養數天內即可形成有管腔的微血管結構,并表現出穩定和成熟的跡象,并通過血管生成和吻合形成相互連接的血管網絡。綜上所述,研究人員通過設計不同的細胞空間排列來控制形成的血管結構的數量、方向、長度和分支行為,從而控制細胞間的相互作用、遷移和增殖,從而研究細胞類型和空間配置如何影響宏觀和微觀血管結構的自組裝。這種將細胞自組裝的能力與血管形成的空間控制相結合的創新策略允許發展獨特而精確的血管化。考慮到組織工程和再生療法的潛在用途,通過自組織形成的血管結構應優于人工生成的血管結構。這項工作代表了通過改變細胞類型和位置,通過細胞自組裝來形成和調節微血管結構的系統研究。
文章來源:
https://doi.org/10.1002/adfm.202208325
(責任編輯:admin)
最新內容
熱點內容


 博世先進陶瓷公司使用Lith
博世先進陶瓷公司使用Lith Xenia進軍大幅面增材制造
Xenia進軍大幅面增材制造 研究人員基于3D打印冰模板
研究人員基于3D打印冰模板 美國Brooks與惠普合作開發
美國Brooks與惠普合作開發 《AHM》:3D打印為患者定
《AHM》:3D打印為患者定 MB Therapeutics與Lynxter
MB Therapeutics與Lynxter 美國空軍引進3D砂
美國空軍引進3D砂 3D打印個性化晶格
3D打印個性化晶格 伊犁州奎屯醫院實
伊犁州奎屯醫院實 昆士蘭科技大學3D
昆士蘭科技大學3D 全彩3D打印吉他在
全彩3D打印吉他在 PSAS成功發射3D打
PSAS成功發射3D打

