納米代謝組學(xué)揭示3D打印血管支架的生物響應(yīng)與代謝奧秘
心血管疾病已成為發(fā)達(dá)國家導(dǎo)致死亡和殘疾的主要原因,血管支架是治療心血管狹窄的有效手段。傳統(tǒng)方法制造的標(biāo)準(zhǔn)支架,因形態(tài)異質(zhì)性、穩(wěn)定性和生物相容性欠佳,容易引發(fā)血栓形成和心肌梗死等問題。3D打印技術(shù)為構(gòu)建個(gè)性化血管支架帶來新希望,3D打印血管支架(3D-PVS)能依據(jù)患者血管結(jié)構(gòu)定制,優(yōu)化機(jī)械性能,拓展臨床適應(yīng)癥。然而,目前3D-PVS的生物相容性分析僅停留在表型層面,其深層分子機(jī)制亟待探索,這限制了3D-PVS的臨床應(yīng)用。
四川大學(xué)華西醫(yī)院的關(guān)俊文、張定坤教授團(tuán)隊(duì)運(yùn)用納米代謝組學(xué)技術(shù),對3D-PVS的生物響應(yīng)及相關(guān)分子機(jī)制展開研究。他們通過對細(xì)胞模型(人臍靜脈內(nèi)皮細(xì)胞)進(jìn)行非靶向納米代謝組學(xué)分析,初步探究3D-PVS對細(xì)胞代謝的影響;再基于此對大鼠模型進(jìn)行靶向納米代謝組學(xué)研究,深入探索3D-PVS誘導(dǎo)的代謝重編程。 相關(guān)工作以“Nanometabolomics elucidated biological response of 3D printed vascular stents: Towards metabolic reprogramming of metabolome and lipidome”為題發(fā)表在《Chemical Engineering Journal》上,為3D-PVS的臨床應(yīng)用提供了重要的理論和技術(shù)支持。

研究內(nèi)容
1. 3D-PVS誘導(dǎo)代謝重編程的研究流程構(gòu)建
通過規(guī)劃并展示一系列實(shí)驗(yàn)步驟,研究如何借助納米代謝組學(xué)技術(shù)來探究3D-PVS誘導(dǎo)的代謝重編程機(jī)制。結(jié)果顯示,該研究流程涵蓋3D-PVS的制備與表征、體外和體內(nèi)模型的構(gòu)建、非靶向和靶向納米代謝組學(xué)分析以及生物信息學(xué)分析等關(guān)鍵環(huán)節(jié),為深入探究3D-PVS植入引發(fā)的代謝重編程分子機(jī)制搭建了合理框架。

2. 3D-PVS的結(jié)構(gòu)表征
運(yùn)用掃描電子顯微鏡(SEM)對3D-PVS進(jìn)行觀察,研究其微觀結(jié)構(gòu)特征。結(jié)果表明,3D-PVS呈現(xiàn)出空心圓柱微晶格結(jié)構(gòu),具備負(fù)泊松比(NPR)特性。這種結(jié)構(gòu)不僅增強(qiáng)了支架的韌性,還顯著提升了其徑向支撐力和抗壓性。同時(shí),3D打印技術(shù)賦予3D-PVS規(guī)則且緊密排列的微觀結(jié)構(gòu),有助于滿足臨床個(gè)性化治療需求。

3. 基于HUVECs模型評估3D-PVS的生物相容性
采用細(xì)胞凋亡檢測、細(xì)胞活力檢測、熒光成像以及海馬細(xì)胞外流量分析等多種方法,以人臍靜脈內(nèi)皮細(xì)胞(HUVECs)為模型,研究3D-PVS的生物相容性。結(jié)果顯示,低濃度(5mg/mL)和高濃度(15mg/mL)的3D-PVS在一定程度上具有較好的生物相容性。不過,15mg/mL的3D-PVS會促使細(xì)胞內(nèi)活性氧(ROS)產(chǎn)生和積累,抑制葡萄糖攝取與利用。但總體而言,在安全濃度范圍內(nèi),3D-PVS的ROS相關(guān)毒性較低,對細(xì)胞的影響在可接受范圍內(nèi)。
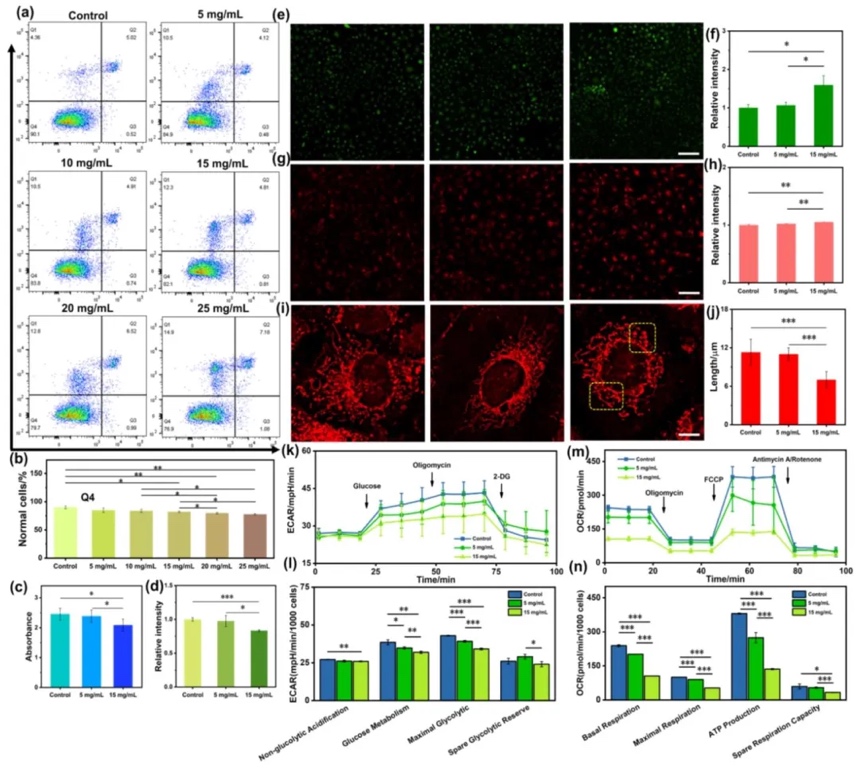
4. 非靶向水性代謝組學(xué)研究
利用LC-MS/MS系統(tǒng)進(jìn)行非靶向水性代謝組學(xué)分析,研究3D-PVS處理后的HUVECs在代謝層面的變化。結(jié)果發(fā)現(xiàn),5mg/mL和15mg/mL的3D-PVS處理組與對照組相比,在代謝組水平上存在顯著差異。共鑒定出123種差異代謝物,這些代謝物涉及氨基酸、有機(jī)酸和脂肪酸等多個(gè)代謝途徑。其中,15mg/mL的3D-PVS誘導(dǎo)的代謝變化更為明顯,體現(xiàn)出一定的劑量依賴性。
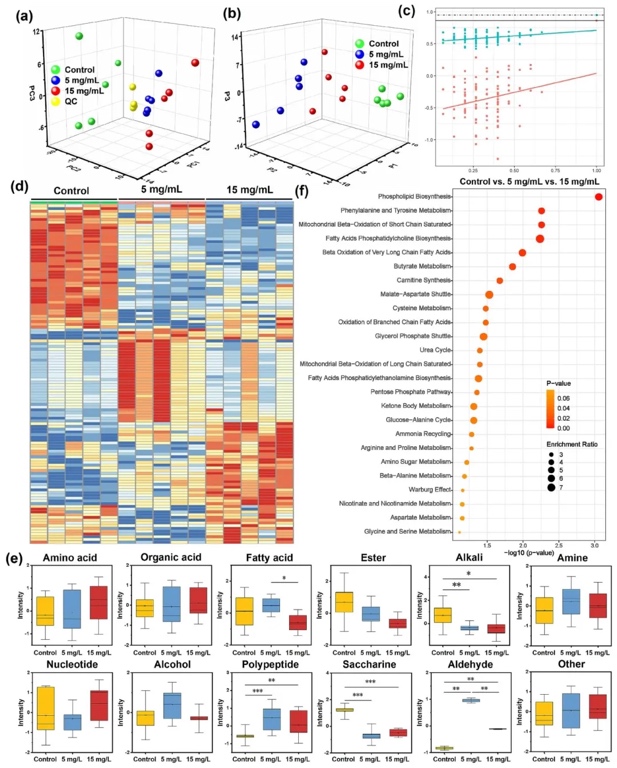
5. 非靶向脂質(zhì)組學(xué)研究
借助LC-MS/MS系統(tǒng)開展非靶向脂質(zhì)組學(xué)分析,探究3D-PVS處理后HUVECs的脂質(zhì)組變化情況。結(jié)果表明,3D-PVS處理組與對照組在脂質(zhì)組水平上呈現(xiàn)出明顯差異,共檢測到2585種差異脂質(zhì),分屬于26個(gè)脂質(zhì)類別。15mg/mL的3D-PVS對差異脂質(zhì)水平的干擾程度大于5mg/mL的3D-PVS,5mg/mL的3D-PVS也對脂質(zhì)組產(chǎn)生了一定影響,進(jìn)一步證實(shí)了3D-PVS與細(xì)胞相互作用的劑量依賴性。

6. 體內(nèi)模型的病理、成像和生化研究
通過建立大鼠體內(nèi)模型,對植入3D-PVS后的大鼠進(jìn)行病理染色,并檢測氧化應(yīng)激相關(guān)生物標(biāo)志物,研究3D-PVS植入對大鼠體內(nèi)的影響。結(jié)果顯示,3D-PVS在體內(nèi)表現(xiàn)出較好的生物相容性,未引起主要組織明顯的形態(tài)學(xué)差異。然而,植入3D-PVS會導(dǎo)致大鼠體內(nèi)產(chǎn)生一定程度的氧化應(yīng)激,具體表現(xiàn)為ROS和丙二醛(MDA)水平升高,而超氧化物歧化酶(SOD)、谷胱甘肽過氧化物酶(GPx)和過氧化氫酶(CAT)等抗氧化酶的水平下降。

7. 靶向水性代謝組學(xué)研究
運(yùn)用LC-MS/MS技術(shù)進(jìn)行靶向水性代謝組學(xué)分析,研究3D-PVS植入后大鼠靜脈的代謝變化。結(jié)果表明,3D-PVS植入顯著影響了靜脈中的糖酵解和氨基酸代謝過程。其中,糖酵解過程增強(qiáng),同時(shí)色氨酸、蛋氨酸和半胱氨酸等多種氨基酸代謝途徑發(fā)生波動。這些代謝變化有助于細(xì)胞抵抗3D-PVS植入引發(fā)的氧化應(yīng)激、炎癥反應(yīng)和免疫排斥,維持代謝穩(wěn)態(tài)。

8. 靶向脂質(zhì)組學(xué)研究
借助LC-MS/MS技術(shù)進(jìn)行靶向脂質(zhì)組學(xué)分析,探究3D-PVS植入后大鼠靜脈的脂質(zhì)代謝變化。結(jié)果發(fā)現(xiàn),3D-PVS植入導(dǎo)致靜脈中磷脂(如PC、PE和PS)水平升高,脂肪酸水平也相應(yīng)上升,甘油三酯(如MAG和DAG)和膽固醇酯(CE)水平增加,鞘脂(如Cer和SM)水平下降,肉堿(Car)水平升高。這表明3D-PVS植入引發(fā)了脂質(zhì)代謝的改變,使脂質(zhì)代謝傾向于能量儲存,同時(shí)對細(xì)胞的正常凋亡過程產(chǎn)生了一定干擾。

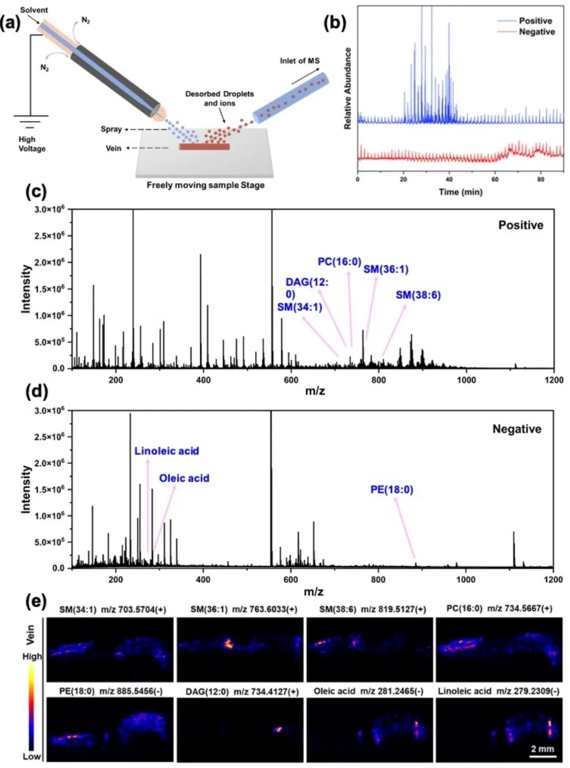
9. 空間代謝組學(xué)研究
采用解吸電噴霧電離質(zhì)譜成像(DESI-MSI)技術(shù),研究3D-PVS處理后大鼠靜脈中差異代謝物的相對豐度和空間分布。結(jié)果顯示,3D-PVS處理導(dǎo)致部分脂質(zhì)(如SM(34:1)、SM(36:1)、SM(38:6)、PC(32:0)、PE(41:4)和DAG(35:4))水平下降,而脂肪酸(如油酸和亞油酸)水平升高。這一結(jié)果與靶向代謝組學(xué)和脂質(zhì)組學(xué)的研究結(jié)果相符,進(jìn)一步證實(shí)了3D-PVS會引起差異代謝物和脂質(zhì)的重編程。
10. “3D-PVS-生物體”相互作用的生物事件示意圖
通過整合各項(xiàng)實(shí)驗(yàn)結(jié)果繪制示意圖,研究3D-PVS與生物體相互作用過程中的生物事件。結(jié)果表明,體外非靶向納米代謝組學(xué)顯示3D-PVS影響細(xì)胞代謝相關(guān)途徑;體內(nèi)靶向納米代謝組學(xué)揭示3D-PVS誘導(dǎo)代謝重編程,涉及糖酵解、氨基酸代謝和脂質(zhì)代謝等;空間代謝組學(xué)展示了差異脂質(zhì)的空間分布變化。這些結(jié)果共同揭示了3D-PVS在生物體內(nèi)的作用機(jī)制和代謝影響。

研究結(jié)論
本研究利用納米代謝組學(xué)(包括非靶向/靶向水性代謝組學(xué)、脂質(zhì)組學(xué)和空間代謝組學(xué))闡釋了3D打印血管支架(3D-PVS)的生物響應(yīng)。這是首次運(yùn)用納米代謝組學(xué)方法,從代謝層面研究3D-PVS生物效應(yīng),并獲取多維度生物信息。研究結(jié)果顯示,3D-PVS在體外的安全濃度(<15mg/mL)會影響氨基酸或有機(jī)酸相關(guān)代謝,以及磷脂、鞘脂或甘油酯相關(guān)代謝。體內(nèi)研究發(fā)現(xiàn),3D-PVS能促進(jìn)糖酵解和氨基酸代謝(包括色氨酸、半胱氨酸和甲硫氨酸、谷氨酸和賴氨酸代謝),并調(diào)節(jié)部分脂質(zhì)類別(如PC、PE、PS、MAG、DAG、Cer、SM、CE、Car和FFA)的穩(wěn)態(tài)。該研究為3D-PVS在生化、醫(yī)學(xué)和工業(yè)領(lǐng)域的應(yīng)用和發(fā)展提供了新視角,同時(shí)推動了納米代謝組學(xué)在闡釋3D打印納米材料生物醫(yī)學(xué)干預(yù)機(jī)制方面的技術(shù)和方法進(jìn)步。
挑戰(zhàn)與展望
盡管本研究借助納米代謝組學(xué)對3D打印血管支架(3D-PVS)的生物響應(yīng)有了深入了解,但仍面臨挑戰(zhàn)。在代謝機(jī)制方面,雖然明確了3D-PVS對代謝途徑的影響,但具體分子調(diào)控網(wǎng)絡(luò)還不夠清晰,關(guān)鍵代謝節(jié)點(diǎn)的上下游調(diào)控關(guān)系有待進(jìn)一步挖掘。從臨床轉(zhuǎn)化角度看,本研究僅在細(xì)胞和大鼠模型上進(jìn)行,距離臨床實(shí)際應(yīng)用還有差距,不同個(gè)體間的差異可能導(dǎo)致3D-PVS的代謝響應(yīng)不同,如何將研究成果精準(zhǔn)應(yīng)用于臨床是一大難題。 展望未來,一方面可深入探究3D-PVS影響代謝的分子調(diào)控細(xì)節(jié),構(gòu)建完整的調(diào)控網(wǎng)絡(luò)模型,為理解其生物效應(yīng)提供更堅(jiān)實(shí)的理論基礎(chǔ)。另一方面,加強(qiáng)與臨床醫(yī)學(xué)的合作,開展更多人體相關(guān)研究,評估3D-PVS在不同人群中的代謝響應(yīng)差異,推動其從實(shí)驗(yàn)室走向臨床應(yīng)用,為心血管疾病治療帶來新突破。
文章來源:
https://doi.org/10.1016/j.cej.2025.161051
(責(zé)任編輯:admin)


 Fabric8Labs推出AI芯片定
Fabric8Labs推出AI芯片定 Titomic又一合作,將與nuF
Titomic又一合作,將與nuF 荷蘭公司將開設(shè)3D打印船舶
荷蘭公司將開設(shè)3D打印船舶 Chicago Additive推出AMOS
Chicago Additive推出AMOS 590MHz帶寬+超90%輻射效率
590MHz帶寬+超90%輻射效率 威斯康星大學(xué)麥迪遜分校工
威斯康星大學(xué)麥迪遜分校工 突破性生物3D打印
突破性生物3D打印 迪拜LEAP 71公司
迪拜LEAP 71公司 3D生物打印構(gòu)建內(nèi)
3D生物打印構(gòu)建內(nèi) 《Small Science
《Small Science 南洋理工-劍橋大
南洋理工-劍橋大 清華大學(xué):抗拉強(qiáng)
清華大學(xué):抗拉強(qiáng)

