哈佛大學醫學院《Science》子刊:利用3D打印治療鈣化主動脈瓣病(2)
時間:2024-03-13 11:41 來源:EngineeringForLife 作者:admin 閱讀:次
【EV載體蛋白質組學研究發現CAVD病理中的差異負載】
有證據表明,EV在動脈粥樣硬化和CAVD(鈣化性心血管疾病)中發揮著基礎性作用。為了評估EV在體外CAVD建模中的作用,本研究進行了EV載體蛋白質組學分析。本研究分離了EV并通過納米粒子追蹤分析確定了適當的大小范圍。對分離的EV進行的蛋白質組學分析鑒定出了1300多種蛋白質,其中包括26種常見的EV標記物(圖5A)。主成分分析顯示了模型和培養基標記的EV蛋白質組之間的明顯聚類(圖5B和C)。與細胞蛋白質組學分析不同,所有培養基條件(NM、OM、PM)在體外模型之間產生了類似數量的差異EV載體蛋白質(圖5E)。然而,總體上EV蛋白質組更加穩定:在任何體外模型的任何培養基處理中,只有平均5%(977個蛋白質中的42個)的總蛋白質豐度存在差異(圖5E),而在NM條件下細胞蛋白質組中有15%存在差異(圖3H)。在2D和3D模型中,所有差異的EV載體蛋白質中,僅有不到4%在不同培養基處理之間共享,這表明每種培養基和模型都具有獨特的負載響應(圖5F至H)。在2D NM模型中,與EV載體的關鍵差異與整合素介導的信號傳導(CD63、FLNA、FERMT2和FERMT3)以及線粒體膜相關的凋亡(YWHA家族)有關(圖5F)。OM EV載體差異與超氧化物調節(PRDX2、APOA4和SOD2)以及細胞外基質組裝(TNXB、PXDN、LAMB1和EMILIN1)有關(圖5G)。最后,PM EV載體的變化與纖溶酶原(ENO1和THBS1)以及細胞外基質(VIM、MFAP4和EMILIN1)有關(圖5H)。
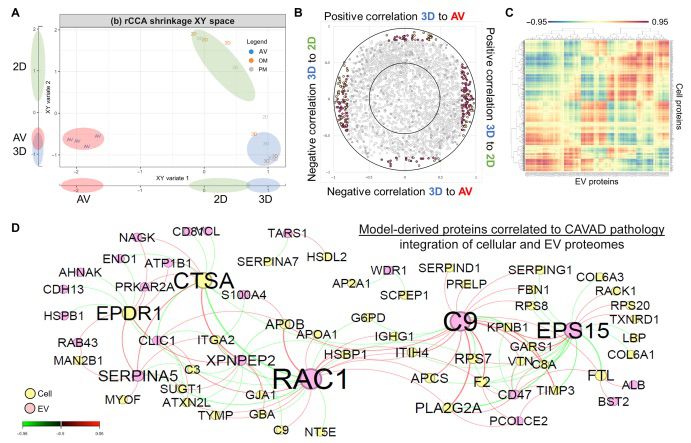
圖5 EV蛋白質組學鑒定了基質依賴的物質加載和普遍存在的與主動脈瓣相關的物質
【多層次組學數據集的整合顯示了CAVD重現的關鍵驅動因素】
在深入描述細胞和EV蛋白質組中的差異豐度模式后,本研究的目標是研究這些蛋白質組之間的關聯模式,以確定在不同刺激條件下3D打印水凝膠模型和2D培養條件中重現CAVD病理的蛋白質。為此,本研究利用了兩種計算分析方法:正則化典型相關分析(rCCA)(圖6)和用于單個樣本的線性插值網絡估計(LIONESS)(圖7),每種方法闡明了不同的關聯方面。首先,本研究旨在檢查細胞和EV數據集中的哪些蛋白質推動了體外鈣化模型和原發性CAVD組織的重現。本研究使用rCCA來識別正交分量或變量之間的最大相關性(圖6A至D)。典型分量1顯示了2D和3D體外模型之間的高相關性,而典型分量2顯示了3D模型和CAVD組織之間的高相關性(圖6A)。相關圓圈圖用于可視化典型分量之間的關系,其中每個點代表細胞或EV蛋白質組中的一個蛋白質(圖6B)。通過對這些數據進行閾值處理,本研究確定與每個典型分量顯著相關的蛋白質(圖6B和C)。本研究觀察到了具有相同類型相關性的變量(蛋白質)的子集簇(圖6C)。與之相對應的相關網絡顯示了推動鈣化水凝膠和CAVD組織之間相關性的細胞和EV載體蛋白質(圖6D)。本研究發現,雖然EV蛋白質占兩個數據集的比例不到10%,但它們占據了推動CAVD和體外模型中鈣化的蛋白質的30%以上。在被確定為與CAVD組織重現鈣化模型的98%的蛋白質(65個中的64個,P < 0.05,根據精確二項檢驗)之前已被認為與心血管疾病有關(PheGenI,美國國家生物技術信息中心)。這些綜合的多層次蛋白質組學分析方法確定了鈣化的已知和未知驅動因素,并確定了這種3D水凝膠模型在體外重現CAVD疾病方面的改進。
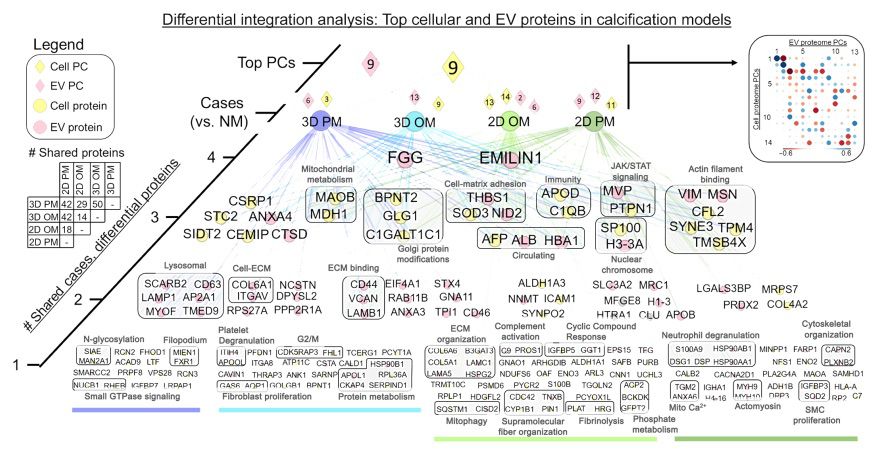
圖6 通過整合細胞和EV載體衍生的蛋白質組,對鈣化模型中疾病重現的網絡分析進行了研究
最后,本研究旨在利用多組學整合和系統生物學方法,確定在這些模型中與鈣化有關的已知和未知蛋白質。圖7中顯示的網絡是由三種類型的節點構成的頂部加載信息:比較鈣化模型(案例和圓角正方形)、細胞和EV層的兩個主要成分(鉆石)以及這些主要成分的加載蛋白質(圓圈;黃色代表細胞,粉色代表EV)(圖6A)。根據它們在模型中的共享程度,進一步對蛋白質節點進行分類,網絡從最共享到最特定進行組織排列(圖7的第4到第1層)。在60多個細胞和EV來源的蛋白質中,至少與另一個條件共享(圖7的第2到第4層),突出顯示了獨立于維度或磷酸鹽類型的驅動CAVD模型中鈣化的蛋白質。在這個綜合分析中,僅有四種蛋白質被確認為細胞和EV蛋白質組之間的共享驅動因子,它們是維納蛋白(VTN)、乳糖粘附蛋白(MFGE8)、聚類素(CLU)和鈣蛋白L1H(S100A9)。在無偏子簇中,共享生物過程的蛋白質被分組(圖7)。在三個條件之間共享的細胞和EV蛋白質中,突出的過程包括線粒體代謝(MAOB和MDH1)、細胞-基質粘附(THBS1、SOD3和NID2)以及肌動蛋白絲結合(VIM、MSN、CFL2、SYNE3、TPM4和TMSB4X)。僅有19%(215個中的41個,P < 0.05,根據精確二項檢驗)的蛋白質被確認為先前與瓣膜疾病有關(PheGenI,NCBI)。這個綜合分析突顯了體外鈣化的已知和未知驅動因素。
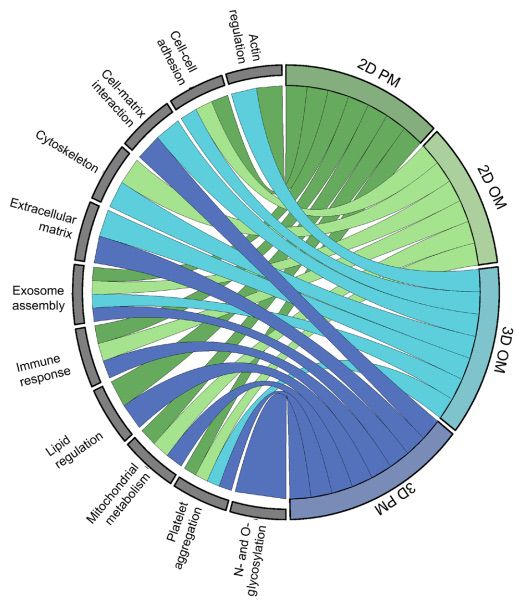
圖7 將細胞和EV載體衍生的蛋白質組進行多組學整合,對鈣化過程中已知和未知的蛋白質進行差異豐度排名
圖8顯示了每個體外模型中最好重現疾病的生物途徑的圖形摘要。本研究發現3D水凝膠模型能夠重現人類CAVD組織的ECM蛋白質組、細胞-ECM相互作用和線粒體代謝調節的蛋白質譜。然而,無論是2D還是3D模型,在免疫/炎癥反應方面都缺乏組織中發現的響應。雖然在瓣膜鈣化的背景下,免疫共培養研究有限,但最近的單細胞研究表明細胞間的跨類型細胞間通信在鈣化性瓣膜疾病中的重要性。本研究提出的模型為進一步增加復雜性提供了基礎,例如共培養其他細胞類型、(病理)生理性周期性剪切/拉伸和額外的層特異性生物力學。雖然我們的研究主要關注纖維層和海綿層的特性,但富含彈性蛋白和受疾病保護的心室內膜在培養條件下已被證明在體內驅動獨特的蛋白質特征,并且很可能主要對應于拉伸而不是壓縮應力的瓣膜生理響應。
圖8 總結每個模型在細胞和EV方面對CAVD組織重現的GO術語
2. 總結與展望
本研究注意到在NM條件下出現了輕度的自發性鈣化,這可能是由于在生物打印過程中暴露于剪切應力和高達75 bar的壓力,這兩者都已被證明可以誘導肌成纖維細胞的活化。此外,本實驗中使用的VICs來自患有疾病的人類瓣膜,可能包含了本研究團隊之前證明的成骨肌成纖維細胞樣細胞的一群細胞。盡管如此,與NM對照組相比,在3D培養中,在鈣化培養基處理條件下,本研究在細胞和EV載體中發現了顯著的蛋白質組學變化,證明了該模型的可行性。本研究利用基于自下而上的蛋白質組學鑒定的肽段的種屬特異性,對細胞外基質(ECM)和其他潛在污染物進行了背景蛋白質組的整理。在未來的研究中,本研究將致力于使用針對ECM的蛋白質組學技術,來識別對膠原亞型、翻譯后修飾和細胞-基質相互作用的機械響應。這些技術還可用于評估細胞和EV對水凝膠中使用的不同基質微環境的反應。這種EV分析還可以擴展到識別驅動EV與微囊泡分泌及其相應蛋白質組的因素。
文章來源:
https://www.science.org/doi/10.1126/sciadv.adj9793
(責任編輯:admin)
最新內容
熱點內容


 Vertico推出可持續模塊化3
Vertico推出可持續模塊化3 亞利桑那大學研發3D打印可
亞利桑那大學研發3D打印可 對比不同來源骨塊移植物:
對比不同來源骨塊移植物: 交貨周期、材料浪費均減半
交貨周期、材料浪費均減半 增材制造賦能運動裝備:Ca
增材制造賦能運動裝備:Ca 美國CoAspire與Divergent
美國CoAspire與Divergent 普惠公司推出新的
普惠公司推出新的 得克薩斯州將建成
得克薩斯州將建成 美軍推進遠程3D混
美軍推進遠程3D混 3D打印的熱交換器
3D打印的熱交換器 3D打印實現外固定
3D打印實現外固定 哥倫比亞大學采用
哥倫比亞大學采用

